CHIMIE La nomenclature chimique
Noms des substances
La nomenclature systématique peut être plus ou moins complexe selon la quantité d'informations qu'on veut lui voir véhiculer. En outre, on distingue différents types de nomenclature (binaire, de coordination, substitutive), correspondant à des types de chimie différents, bien que certains composés puissent être décrits selon deux types de nomenclature.
Nomenclature binaire
Elle est fondée sur la stœchiométrie et concerne essentiellement les composés inorganiques. Elle distingue la partie positive et la partie négative de la molécule, en utilisant les termes électropositif et électronégatif, bien que ce ne soit pas une notion très rigoureuse. On construit alors le nom en combinant celui de la partie positive et celui de la partie négative, éventuellement affectés de préfixes multiplicatifs. Ces parties peuvent être des éléments, des radicaux, des groupes fonctionnels, des ions ou des molécules.
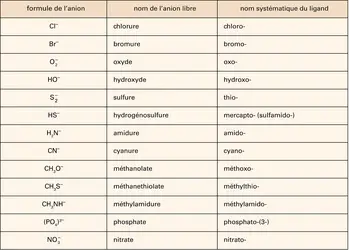
Le nom de la partie électropositive est celui de l'élément, d'un cation polyatomique, ou d'un groupe porteur d'un nom reconnu. Ex. : NaBr, bromure de sodium ; OF2, difluorure d'oxygène ; NH4Cl, chlorure d'ammonium ; UO2Cl2, dichlorure d'uranyle. En anglais, on cite d'abord l'élément électropositif (sodium bromide), mais, dans les deux cas, c'est l'élément électropositif qui est mis en valeur. L'hydrogène est toujours cité en dernier parmi les cations. S'il y a plus d'un constituant électropositif, on prend l'ordre alphabétique (KMgCl3, chlorure de magnésium et de potassium). Lorsque les noms deviennent plus complexes, on recommande souvent une nomenclature proche de la nomenclature officielle en anglais, voire directement le nom anglais, afin de le retrouver plus facilement dans les bases de données. Dans les catalogues de produits chimiques, le nom anglais est le plus sûr moyen de trouver le composé recherché, mais le nom français, et parfois le nom trivial, figurent souvent. Ainsi le composé AlK(SO4)2 • 12H2O, sulfate d'aluminium et de potassium dodécahydraté, se trouve-t-il aussi sous le nom aluminium potassium bis(sulfate)-water 1/12, ainsi que sous la dénomination alun de potasse.
On trouve encore des noms de cations construits selon la méthode de la nomenclature substitutive (voir plus loin), en particulier lorsqu'un ou plusieurs ions H+ sont ajoutés à l'élément ; on a alors la terminaison -onium : PH4+, phosphonium ; H3O+, oxonium ; H3S+, sulfonium ; NH4+, ammonium. Pour des cations plus complexes, on utilisera la nomenclature de coordination (voir plus loin).
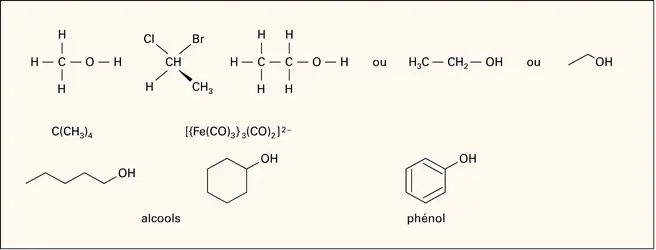
Le nom de la partie électronégative est, pour les anions monoatomiques, le nom de l'élément suivi de la terminaison -ure, qui indique qu'il s'agit d'un anion (la désinence officielle de l'I.U.P.A.C. est -ide) : NaBr, bromure de sodium (sodium bromide). S'il y a plusieurs constituants électronégatifs, on les place dans l'ordre alphabétique. Pour les anions de plusieurs atomes, les noms sont construits de diverses façons. S'il s'agit du même anion, on utilise les préfixes multiplicatifs di-, tri- (BF3, trifluorure de bore), tétra-, penta-, hexa-, hepta-, octa-, nona-, déca-, undéca-, dodéca-, tridéca- (pour 13), etc., icosa- (pour 20), hénicosa- (pour 21), docosa- (pour 22), etc., triaconta- (pour 30), etc., tétraconta- (pour 40), etc., hecta- (pour 100), etc. Quelques noms triviaux sont toujours en usage : O2—, superoxyde ; O22—, peroxyde, N3—, azoture. Mais en règle générale on utilise la terminaison -ate, caractéristique en particulier des anions d'acides oxygénés : SO42—, sulfate ; PO43—,phosphate ; NO32—, nitrate ; etc. La désinence -ate est aussi utilisée quand des H+ sont enlevés d'un OH, comme pour les alcools (CH3O—, méthanolate), ainsi que lorsque l'anion est obtenu par addition d'un[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Nicole J. MOREAU : professeur des Universités, docteur ès sciences
Classification
Médias
Autres références
-
ACIDES & BASES
- Écrit par Yves GAUTIER et Pierre SOUCHAY
- 12 367 mots
- 7 médias
Un acide est un corps capable de céder un ou des protons (une particule fondamentale chargée d'électricité positive) et une base est un corps capable de capter un ou des protons. Chacun a ses caractéristiques. Les acides ont une saveur aigre (l'adjectif latin acidus signifie « aigre...
-
AIR, élément
- Écrit par Georges KAYAS
- 719 mots
- 1 média
Anaximène (~ 556-~ 480), à la différence de Thalès, enseignait que toute substance provient de l'air (pneuma) par raréfaction et condensation ; dilaté à l'extrême, cet air devient feu ; comprimé, il se transforme en vent ; il produit des nuages, qui donnent de l'eau lorsqu'ils sont...
-
ANALYSE ET SYNTHÈSE, chimie
- Écrit par Pierre LASZLO
- 1 526 mots
- 1 média
Ces deux notions, en principe complémentaires et réciproques, ne le sont pas en fait. Certes, les deux tendances à l'analyse et à la synthèse s'opposent, la première visant à couper les entités chimiques en petits morceaux et la seconde se donnant pour objectif la reconstruction des ensembles mis à...
-
ANALYTIQUE CHIMIE
- Écrit par Alain BERTHOD et Jérôme RANDON
- 8 890 mots
- 4 médias
« C'est dans les cas situés au-delà de la règle que le talent de l'analyste se manifeste. L'important, le principal est de savoir ce qu'il faut observer. » Edgar Allan Poe (Histoires extraordinaires, 1844)
La chimie analytique est la branche de la chimie qui a pour but l'identification,...
- Afficher les 82 références