ORGANIQUE CHIMIE
Article modifié le
En dehors des deux thèmes de recherche fondamentaux, la pierre philosophale et l'élixir, les alchimistes avaient réussi, grâce à des recettes plus ou moins rationnelles, à élaborer de nombreuses substances (qui sont, à quelques impuretés près, ce qu'on appelle aujourd'hui composés définis), dont quelques-unes avaient déjà des applications pratiques.
Mais l'origine des matières premières mises en œuvre, tirées de l'air, de l'eau, de la terre ou de la matière vivante, n'avait pas retenu particulièrement l'attention ; c'est Nicolas Lémery qui, dans son Cours de chymie (1690), distingue le premier la « chimie minérale », qui ne fait appel, au départ, qu'à la matière inerte, et la « chimie organique », qui puise ses sources dans le règne animal ou dans le règne végétal.
Cette distinction était justifiée par le dogme de la « force vitale », seule cause mystérieuse censée être alors capable d'édifier in vivo des composés comme l'« alcool vini » (l'éthanol) ou l'acide acétique.
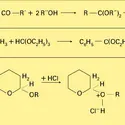
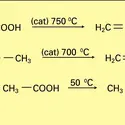
Comme toutes les sciences de la matière, la chimie a vu successivement se développer ses aspects extractif, descriptif, explicatif. Les chimistes des xviie et xviiie siècles savaient du moins transformer l'une en l'autre deux substances quelconques extraites du règne vivant, par exemple oxyder in vitro l'alcool en acide acétique ; mais ils avaient également isolé et décrit des substances que le monde vivant ne fournit point, tels le chlorure d'éthyle, résultant de l'action de l'acide muriatique (acide chlorhydrique) sur l'alcool, et l'éther dit sulfurique (oxyde d'éthyle), résultant de la déshydratation de l'alcool sous l'influence de l'huile de vitriol (acide sulfurique).
Ces produits de transformation devenaient de plus en plus nombreux, et les substances directement extraites du règne vivant ne constituaient, vers 1850, qu'une faible minorité du domaine de la « chimie organique », dont l'unité n'était sauvegardée que par le respect du dogme de la force vitale.
Berthelot, s'appuyant sur quelques « synthèses », à partir de matières extraites du monde inerte, de substances considérées jusqu'alors comme spécifiquement organiques : alcool, méthane, méthanol, benzène, etc., émit l'hypothèse que toute substance organique pouvait être synthétisée in vitro à partir d'éléments minéraux ; l'avenir devait parfaitement justifier cette hypothèse.
La barrière édifiée par Lémery tombait. Cependant, la « chimie organique » subsiste, mais il convient d'en modifier la définition. Il existe aujourd'hui une « chimie des substances naturelles », qui répond à la conception ancienne, et une chimie organique plus générale, qui englobe la quasi-totalité des substances renfermant du carbone, si l'on en excepte le carbone natif, les carbonates minéraux et les carbures métalliques.
Les substances organiques naturelles renferment toujours du carbone, presque toujours de l'hydrogène, très souvent de l'oxygène, souvent de l'azote, parfois du soufre ; en outre, les substances artificielles renferment, éventuellement, des halogènes et, avec des fréquences très variables, la totalité des autres éléments.
Caractères fondamentaux
Les liaisons organiques sont essentiellement covalentes ; seuls quelques dérivés organométalliques présentent un caractère salin, d'ailleurs très limité, l'anion restant covalent.
En conséquence, les substances organiques sont, pour la plupart, des molécules ou des macromolécules ; cela implique des points de fusion et d'ébullition relativement bas ainsi que des solubilités élevées dans des solvants eux-mêmes organiques et, le plus fréquemment, une faible aquasolubilité, sauf pour les molécules riches en oxygène[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
- Charles PRÉVOST : professeur à la faculté des sciences de Paris, à l'École centrale des arts et manufactures de Paris et à l'École normale supérieure de Fontenay-aux-Roses
Classification
Média
Autres références
-
ACÉTALS
- Écrit par Jacques METZGER
- 866 mots
- 1 média
Les acétals sont les composés gem-dialcoxylés c'est-à-dire qui portent sur le même atome de carbone tétracoordiné de la chaîne deux fonction éther-oxyde. Ils dérivent formellement de l'élimination d'une molécule d'eau entre un dérivé carbonylé et deux molécules d'alcool (réaction 1). On distingue...
-
ACÉTAMIDE (éthanamide)
- Écrit par Dina SURDIN
- 328 mots
CH3—CO—NH2
Masse moléculaire : 59,07 g
Masse spécifique : 1,16 g/cm3
Point de fusion : 82 0C
Point d'ébullition : 222 0C.
Monoamide primaire se présentant en cristaux blancs hexagonaux ou rhomboédriques. La structure cristalline de l'acétamide déterminée par les rayons X (méthode du...
-
ACÉTIQUE ACIDE
- Écrit par Jacques METZGER
- 2 113 mots
- 3 médias
L'acide acétique, acide organique de formule CH3COOH, est le membre le plus important de la famille des acides carboxyliques. Il joue avec ses dérivés un rôle essentiel dans de nombreuses synthèses et dégradations biologiques accompagnant le métabolisme des aliments et la formation des tissus....
-
ACÉTYLACÉTIQUE ESTER
- Écrit par Jacques METZGER
- 1 356 mots
- 2 médias
L'acide acétylacétique est le nom usuel du butanone-3-oïque :

Cet acide a été isolé dans les urines pathologiques. Il peut être obtenu par une hydrolyse prudente de son ester éthylique. Ce dernier, beaucoup plus important, est un intermédiaire utilisé dans l'industrie pharmaceutique et dans...
- Afficher les 158 références
Voir aussi