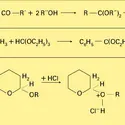
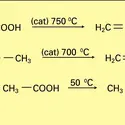
ORGANIQUE CHIMIE
Article modifié le
Les méthodes de la chimie organique
Les principes de l'analyse immédiate sont développés par ailleurs (cf. chromatographie).
Identification d'une substance organique
À l'origine surtout, le point de départ de l'identification d'une substance organique était l'analyse élémentaire. Elle permet de déterminer le pourcentage des divers éléments : C, H, O, N... ; si la masse moléculaire, dont la cryoscopie fournit une valeur approchée, n'est pas trop grande, et si les résultats de l'analyse sont suffisamment précis, on en déduit la formule brute CαHβOγNδ...
Mais, sauf s'il s'agit de composés très simples, à cette formule correspondent un très grand nombre d'isomères entre lesquels il faut faire le départ ; c'est le but de l'analyse fonctionnelle. Pendant longtemps, cette analyse a été purement chimique.
À chaque fonction correspondent des propriétés dont certaines sont très caractéristiques : tous les alcools, notamment, sont transformés en alcoolates par le sodium. Mais la caractérisation de la fonction (ou des fonctions) ne suffit pas ; il faut encore connaître la nature du squelette carboné et la place de la fonction sur ce squelette. Pendant très longtemps, le chimiste en était réduit à des méthodes de transformation menant à un composé antérieurement identifié ; par exemple, la réduction de la plupart des composés organiques mène finalement à un hydrocarbure saturé ou cyclanique. Si celui-ci est connu, le squelette se trouve de ce fait établi. Quant à la place de la fonction sur ce squelette, elle peut être parfois déterminée par comparaison avec des homologues déjà identifiés ; c'est ainsi qu'il existe des méthodes sûres pour distinguer les trois types de substitution d'un carbone hydroxylé (alcools primaires, secondaires, tertiaires).
Mais ces méthodes sont défaillantes dans les cas compliqués ; on a alors recours à des dégradations qui scindent la molécule primitive en divers tronçons plus faciles à identifier. Un cas très simple est celui d'un ester que l'hydrolyse coupe en un acide et en un alcool. Il est bon toutefois de vérifier les hypothèses structurales par une synthèse ; sur l'exemple choisi, il faut montrer que l'acide et l'alcool engendrent bien, par perte d'eau, l'ester en question.
Malheureusement, les exemples retenus sont beaucoup trop simples, et cette analyse sommaire ne reflète qu'imparfaitement les difficultés qu'ont rencontrées les chimistes.
Le problème a été complètement transformé par l'introduction des contrôles physiques de structure : spectrographie ultraviolette, spectrographies infrarouge et Raman, résonance magnétique nucléaire (R.M.N.) et spectrographie de masse, pour ne citer que les plus utiles. Le spectre ultraviolet fournit de précieux renseignements sur l'existence et la nature des liaisons multiples, et le spectre infrarouge (ou Raman), plus général, présente des bandes caractéristiques de toutes les liaisons covalentes. Ces critères ne fournissent pas des renseignements absolus, car les physiciens ne peuvent calculer avec une précision suffisante les fréquences de ces bandes et surtout leurs variations avec la nature du squelette, mais la confrontation avec ces mêmes bandes observées sur des molécules plus simples, de même structure locale, fournit des renseignements inestimables. La résonance magnétique nucléaire, même réservée au proton, permet de compter les atomes d'hydrogène, de distinguer ceux qui jouent le même rôle et ceux qui jouent un rôle différent ; toujours par référence à des composés connus de même structure locale, on peut identifier cette structure.
La spectrographie de masse fournit une valeur très exacte de la masse moléculaire, mais aussi de la masse radicalaire des tronçons provenant de la rupture de la molécule. En admettant que deux molécules voisines ont les mêmes seuils de scission, on peut, par comparaison avec une molécule connue, reconstituer une partie de la structure.
Ces renseignements ont permis d'établir complètement la structure de composés très compliqués, et ce sans analyse fonctionnelle chimique et même, parfois, sans analyse élémentaire. Cela vaut surtout pour la chimie des substances naturelles, car, s'il s'agit d'un produit synthétique, il est rare que l'on ne possède pas quelques présomptions sur sa structure.
Parmi les « méthodes absolues », citons l'étude poussée des spectres de rayons X des molécules cristallisées, travail extrêmement laborieux et nécessitant l'emploi de calculettes, mais qui localise les divers atomes dans l'espace et ne laisse subsister aucun doute sur la structure.
Le problème de l'identification des composés synthétiques est infiniment plus simple. Sauf anomalies imprévisibles, on ne peut guère hésiter qu'entre un très petit nombre de structures ; s'il s'agit de choisir entre des formules non isomériques, une simple analyse quantitative permet de lever le litige. S'il s'agit d'isomères, la spectrographie ou la R.M.N. sont le plus souvent souveraines.
Toutefois, nombreux sont les chimistes qui ne se contentent pas d'une détermination analytique, mais qui préfèrent une détermination synthétique. C'est ainsi que, depuis le début du xxe siècle, les chimistes ont mis un point d'honneur à reproduire synthétiquement des produits naturels dont la structure ne faisait plus de doute. S'il s'agit d'un produit synthétique, la confirmation de la structure consiste à réaliser la synthèse par une voie toute différente de celle qui lui avait donné naissance.
Synthèses
En principe, on appelle synthèse la préparation d'un corps composé à partir de corps simples, mais, surtout en chimie organique, l'extension abusive de ce terme en a fait presque le synonyme de « transformation » ;
On appellera « synthèses totales » celles qui répondent à la définition première : on peut citer, dans ce groupe, l'action de l'hydrogène sur le carbone, qui conduit, à très haute température, à l'acétylène C2H2 et, vers 1 000 0C, au méthane CH4.
Très proche de ce type sont les synthèses « théoriquement totales », c'est-à-dire faisant appel, au départ, à des composés inorganiques dont la synthèse totale est possible ; c'est ainsi que, lorsque le chimiste organicien emploie l'eau ou l'ammoniac à l'édification d'un composé, il n'est pas question pour lui de partir de l'hydrogène, de l'oxygène et de l'azote.
Viennent ensuite les « synthèses partielles ». Le point de départ peut être un composé organique emprunté au règne vivant, tel que l'alcool de fermentation. Cette synthèse est « théoriquement totale », puisque Berthelot a réussi la synthèse totale de l'éthanol. Dans d'autres cas, le chimiste fait appel à des produits naturels dont la synthèse totale n'a pas encore été réalisée ; ces synthèses partielles deviendront théoriquement totales lorsque le produit de départ sera devenu « synthétique ». Il est des domaines dans lesquels cet espoir semble vain ; il est probable que la synthèse totale de la cellulose ne sera jamais possible ; il n'en est pas moins vrai que la cellulose naturelle peut subir de nombreuses transformations, et l'acétylcellulose, par exemple, est un produit « semi-synthétique ».
Initialement, il s'agissait par la synthèse de détruire le dogme de la force vitale et de montrer que la biosynthèse repose sur des processus réactionnels sinon identiques, du moins comparables à ceux qui régissent les réactions effectuées in vitro. La différence essentielle réside dans la puissance et la haute spécificité des enzymes, mais celles-ci ne sont que des catalyseurs, certes compliqués, dont la synthèse totale paraît à l'heure actuelle irréalisable, bien qu'elle ait pu être réussie récemment dans quelques cas particuliers. Depuis Berthelot, la cause est entendue ; un exemple de plus semble a priori n'apporter qu'une confirmation superflue, mais on conçoit que la reproduction artificielle d'un composé d'origine biologique tente encore le chimiste, ne serait-ce que pour en vérifier la structure encore incertaine, ou pour confirmer la puissance des techniques qui, de jour en jour, se perfectionnent. Rappelons seulement que la formule structurale du camphre n'a été définitivement acceptée que le jour où sa synthèse totale a pu être réussie.
La synthèse a aussi pour but d'éprouver la généralité et les limites des réactions organiques, et surtout l'élaboration d'édifices complexes dont l'étude permet de confirmer ou d'infirmer les hypothèses encore fragiles sur lesquelles reposent nos conceptions sur la réactivité, en particulier d'étudier l'évolution des propriétés des fonctions avec la nature du squelette qui les porte. Elle a permis de montrer que quelques structures que la théorie élémentaire de la valence permettait de prévoir sont ou bien interdites, ou seulement stables aux très basses températures.
L'aspect pratique de la synthèse est bien plus important encore. Beaucoup de produits, autrefois exclusivement naturels, présentent un gros intérêt, par eux-mêmes ou en tant que matières premières, pour la préparation de composés plus complexes. Il y a tout avantage à les préparer par synthèse totale ou partielle, que les sources naturelles soient insuffisantes ou que le prix de revient et la pureté d'un produit synthétique le rendent plus avantageux que le produit naturel. C'est ainsi que le méthanol, autrefois extrait péniblement des produits de pyrogénation du bois, est exclusivement préparé de nos jours à partir de l'oxyde de carbone et de l'hydrogène (synthèse totale), ou à partir du méthane naturel (synthèse partielle) ; la purification est alors beaucoup plus simple.
La nature et le laboratoire entrent en concurrence pour d'autres produits : citons l'alcool éthylique qui provient en partie de la fermentation des jus sucrés, en partie d'une synthèse partielle à partir du pétrole, ou des gaz de hauts fourneaux.
Mais la synthèse industrielle ne se borne pas à reproduire dans des conditions avantageuses des produits naturels. L'indigotier et la garance ont été longtemps les sources de deux excellents colorants, l'indigo et l'alizarine. Ceux-ci sont préparés synthétiquement à partir du goudron de houille, la culture de l'indigotier et de la garance n'étant plus rémunératrice. Mais, à côté des colorants naturels, la synthèse a mis à la disposition des teinturiers une gamme très étendue de matières colorantes nouvelles, adaptées aux diverses fibres naturelles et synthétiques. Les mêmes remarques s'appliquent dans le domaine des médicaments et des parfums.
De plus, si de très rares produits naturels sont explosifs, aucun ne peut être employé comme tel, alors que de nombreux produits synthétiques constituent à la fois les explosifs brisants et les poudres propulsives.
Pendant longtemps, des macromolécules naturelles (textiles, caoutchouc, colles, vernis) étaient seules employées en vue de ces usages respectifs, et, en dehors des bakélites (résines phénol-formol), toutes les résines synthétiques étaient considérées comme des sous-produits indésirables de réactions devant en principe conduire à des produits plus simples ; depuis les choses ont complètement changé.
Domestiquées, la haute polymérisation et la haute condensation conduisent à des macromolécules dépassant de loin, dans leur domaine, les produits naturels de même usage. Des textiles artificiels présentent toutes les qualités de la soie, avec une ténacité et une inaltérabilité bien supérieures ; si le caoutchouc naturel est difficilement concurrencé par les caoutchoucs synthétiques en ce qui concerne l'élasticité, les élastomères synthétiques résistent mieux au vieillissement et à l'action des agents chimiques ; les colles synthétiques sont inodores et imputrescibles ; les verres organiques sont plus légers, moins fragiles que les verres minéraux, et leurs éclats sont nettement moins tranchants.
La synthèse des macromolécules est, une des branches les plus importantes de l'industrie organique.
En dehors de quelques matières premières d'origine vivante, de moins en moins nombreuses, la synthèse industrielle fait appel à deux sources principales : la houille et le pétrole.
La houille est le point de départ de la carbochimie ; la distillation de la houille fournit, d'une part, le goudron, source des carbures aromatiques et de leurs dérivés, d'autre part, le coke, matière première pour le monoxyde de carbone, l'hydrogène, l'acétylène.
Le pétrole est la base de la pétrochimie. Le méthane naturel permet, en dehors de nombreuses synthèses, la préparation la plus économique de l'hydrogène ; les termes simples du craquage : éthane, éthylène, propane, propylène isobutane et butènes, sont à la base des intermédiaires de synthèses les plus importants (oxyde d'éthylène, acétaldéhyde, acide acétique, glycol, glycérol...) et à base de macromolécules (polythène, élastomères, résines vinyliques...). Beaucoup de ces intermédiaires dérivaient autrefois de l'acétylène, donc de la carbochimie ; le prix de revient élevé de l'acétylène, bien qu'il puisse également se préparer par pyrogénation du méthane, diminue de beaucoup son importance pratique.
D'autre part, l'aromatisation des hydrocarbures moyens du pétrole donne un accès avantageux au toluène et à ses homologues. Si l'aromatisation de l'hexane en benzène n'est pas encore compétitive, on peut espérer qu'elle le sera un jour ; dès lors, la carbochimie s'effacera à peu près complètement devant la pétrochimie.
Néanmoins, des synthèses partielles restent intéressantes, tout au moins dans le domaine des parfums et des produits pharmaceutiques. C'est là que le mot « synthèse » a le plus perdu de sa signification originelle ; par exemple, la transformation du cholestérol en hormones stéroïdes est couramment appelée « synthèse partielle » ; or, ces hormones sont moins riches en atomes que le cholestérol de départ.
Signalons enfin que la synthèse pratique a des limites. Des composés naturels aussi simples et aussi utiles que les sucres n'ont pu être reproduits artificiellement que récemment, et avec des rendements qui excluent tout espoir d'une synthèse concurrentielle. C'est peut-être moins certain en ce qui concerne les lipides ; quant aux protides naturels, ils sont en général si complexes que leur synthèse pratique ne peut être envisagée.
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
- Charles PRÉVOST : professeur à la faculté des sciences de Paris, à l'École centrale des arts et manufactures de Paris et à l'École normale supérieure de Fontenay-aux-Roses
Classification
Média
Autres références
-
ACÉTALS
- Écrit par Jacques METZGER
- 866 mots
- 1 média
Les acétals sont les composés gem-dialcoxylés c'est-à-dire qui portent sur le même atome de carbone tétracoordiné de la chaîne deux fonction éther-oxyde. Ils dérivent formellement de l'élimination d'une molécule d'eau entre un dérivé carbonylé et deux molécules d'alcool (réaction 1). On distingue...
-
ACÉTAMIDE (éthanamide)
- Écrit par Dina SURDIN
- 328 mots
CH3—CO—NH2
Masse moléculaire : 59,07 g
Masse spécifique : 1,16 g/cm3
Point de fusion : 82 0C
Point d'ébullition : 222 0C.
Monoamide primaire se présentant en cristaux blancs hexagonaux ou rhomboédriques. La structure cristalline de l'acétamide déterminée par les rayons X (méthode du...
-
ACÉTIQUE ACIDE
- Écrit par Jacques METZGER
- 2 113 mots
- 3 médias
L'acide acétique, acide organique de formule CH3COOH, est le membre le plus important de la famille des acides carboxyliques. Il joue avec ses dérivés un rôle essentiel dans de nombreuses synthèses et dégradations biologiques accompagnant le métabolisme des aliments et la formation des tissus....
-
ACÉTYLACÉTIQUE ESTER
- Écrit par Jacques METZGER
- 1 356 mots
- 2 médias
L'acide acétylacétique est le nom usuel du butanone-3-oïque :

Cet acide a été isolé dans les urines pathologiques. Il peut être obtenu par une hydrolyse prudente de son ester éthylique. Ce dernier, beaucoup plus important, est un intermédiaire utilisé dans l'industrie pharmaceutique et dans...
- Afficher les 158 références
Voir aussi