CHIMIE THÉORIQUE
Article modifié le
Les bases de la chimie théorique
L'équation de Schrödinger
L'équation fondamentale de la chimie théorique est l'équation de Schrödinger :

L'opérateur hamiltonien Hop contient à la fois un terme différentiel, assimilable à l'énergie cinétique des particules, et un terme multiplicatif, assimilable à leur énergie potentielle. C'est la présence simultanée de ces deux termes de caractère mathématique très différent qui rend la résolution de l'équation si difficile.
En pratique, une première simplification est apportée en séparant noyaux et électrons. Comme le noyau le plus petit, le proton, est déjà 1 860 fois plus lourd qu'un électron, on suppose que les électrons se déplacent beaucoup plus rapidement que les noyaux. Ainsi, du point de vue d'un électron en mouvement, les noyaux sont essentiellement fixes. C'est l'approximation de Born-Oppenheimer : les noyaux n'ont pas eu le temps de bouger alors que déjà les électrons ont accompli de nombreuses trajectoires.
Il reste que, même réduite aux seuls électrons, l'équation de Schrödinger est impossible à résoudre analytiquement, sauf pour le cas simple d'un électron (atome hydrogène H ou ions hélium He +, lithium Li ++...). Il faut donc trouver des méthodes approchées ; les deux méthodes utilisées communément correspondent chacune à un point de vue différent pour la molécule.
La méthode des liaisons de valence
L'idée de la méthode des liaisons de valence est que la meilleure fonction d'onde pour une molécule est celle qui superpose les fonctions partielles, correspondant chacune à un mode satisfaisant de liaison pour la molécule. Ainsi, pour la molécule d'hydrogène H2, le chimiste peut intuitivement envisager deux modes possibles de liaison pour les deux électrons.
Le premier mode correspond à un partage des deux électrons, provenant de chaque atome, entre les deux atomes, pour former une liaison « covalente ». Dans le second mode, l'un des atomes accapare les deux électrons et porte ainsi une charge électrique négative ; l'autre atome, dépouillé de son électron, porte une charge électrique positive. L'attraction coulombienne entre ces deux charges crée une liaison « ionique ». La méthode des liaisons de valence superpose, pour construire la fonction d'onde globale Ψ, les fonctions d'onde correspondant à ces deux types de liaison.
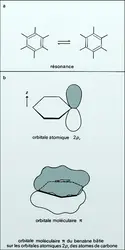
De la même manière, dans la molécule de benzène, les atomes de carbone – chacun pouvant former quatre liaisons avec les atomes voisins – ont le loisir d'organiser leurs liaisons de deux manières. La fonction d'onde Ψ correcte est une superposition des fonctions d'onde correspondant à ces deux structures. Chimiquement, cette construction est d'autant plus satisfaisante qu'elle s'accorde avec la notion de résonance introduite par Pauling, dans laquelle la molécule de benzène est supposée en quelque sorte alterner entre ces deux structures (ou en tout état de cause emprunter ses caractéristiques chimiques simultanément à ces deux structures). On caractérise cette résonance par une flèche à double pointe.
L'intérêt principal de cette[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Lionel SALEM : Directeur de recherche au C.N.R.S., laboratoire de chimie théorique de l'université de Paris-Sud.
- François VOLATRON : professeur agrégé, docteur d'Etat chargé de recherche au CNRS
Classification
Médias
Autres références
-
CHIMIE - Histoire
- Écrit par Élisabeth GORDON , Jacques GUILLERME et Raymond MAUREL
- 11 189 mots
- 7 médias
Quantà la chimie théorique – qui étudie les molécules, leurs propriétés, leurs interactions par les méthodes de la chimie quantique ainsi que par des méthodes stochastiques –, elle joue un rôle important dans tous les domaines de la chimie. Ses progrès, favorisés par l'apparition de calculateurs de... -
EYRING HENRY (1901-1981)
- Écrit par Georges BRAM et Encyclopædia Universalis
- 460 mots
Le physico-chimiste américain Henry Eyring est né le 20 février 1901 à Colonia Juárez, au Mexique. En 1912, sa famille est expulsée du pays par les insurgés et s’installe en Arizona – Eyring deviendra citoyen américain en 1935. Il commence ses études supérieures à l'université d'Arizona où il obtient...
-
KOHN WALTER (1923-2016)
- Écrit par Bernard PIRE
- 449 mots
Physicien théoricien de la matière condensée, Prix Nobel de chimie en 1998, Walter Kohn a fait progresser la compréhension de la structure électronique des atomes, des molécules et des matériaux solides. L'application de sa méthode originale a permis des avancées spectaculaires en physique, en chimie...
-
LIAISONS CHIMIQUES - Liaison et classification
- Écrit par André JULG
- 8 250 mots
- 7 médias
Le problème de la nature de la liaison chimique s'est posé dès que fut entrevue la structure discontinue de la matière. Depuis l'Antiquité, chaque époque s'y est intéressée, proposant des solutions adaptées à ses connaissances. Démocrite munissait les particules de petits crochets afin de leur permettre...
- Afficher les 7 références
Voir aussi
- BUTADIÈNE
- LEWIS THÉORIE DE
- RÉACTIONNELS MÉCANISMES
- ORBITALES ATOMIQUES
- PARAMAGNÉTISME
- DÉLOCALISATION ÉLECTRONIQUE
- HAMILTONIEN
- SCHRÖDINGER ÉQUATION DE
- TRANSITION ÉTAT DE
- MOLÉCULES DIATOMIQUES
- COVALENTE LIAISON
- PI ORBITALE
- ORBITALES MOLÉCULAIRES
- ORBITALES LIANTES
- FONCTION D'ONDE
- HÜCKEL RÈGLE DE
- ORBITALES ANTILIANTES
- COUCHES ÉLECTRONIQUES
- HUND RÈGLE DE
- ÉNERGIE POTENTIELLE
- LIAISONS DE VALENCE MÉTHODE DES
- QUANTIQUE MÉCANIQUE
- PAULI PRINCIPE D'EXCLUSION DE
- ÉLECTRONIQUE STRUCTURE
- NIVEAU, physique atomique
- STABILITÉ, chimie
- CHIMIE HISTOIRE DE LA
- BORN & OPPENHEIMER APPROXIMATION DE
- HARTREE-FOCK ÉQUATION DE
- IONIQUE LIAISON
- FUKUI KENICHI (1918-1998)
- FERROCÈNE
- WOODWARD & HOFFMANN RÈGLES DE
- MOMENT MAGNÉTIQUE