CHIMIE THÉORIQUE
Article modifié le
Quelques découvertes importantes de la chimie théorique
Surfaces de potentiel et « état de transition »
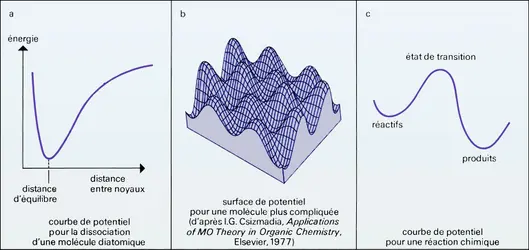
En partant de l'approximation de Born-Oppenheimer, le chimiste théoricien peut calculer l'énergie d'une molécule pour n'importe quelle disposition relative des noyaux. Ainsi, pour une molécule diatomique, il peut évaluer l'énergie en fonction de la distance entre les deux noyaux. Il obtient une courbe appelée courbe de potentiel. Cette courbe de potentiel, comme ses formes plus compliquées appelées surfaces de potentiel lorsque le nombre d'atomes est plus grand, représente en quelque sorte la géographie « énergétique » du terrain (vallées, montagnes) que doit emprunter la molécule quand elle se déforme.
Pour une molécule diatomique, la courbe de potentiel a un puits dont le fond correspond à la position d'équilibre de la molécule, entourée d'un côté par un mur brusque (noyaux trop rapprochés) et de l'autre par une montée plus douce. Cette pente douce correspond à l'élongation progressive de la liaison et à la dissociation de la molécule. Cette forme de courbe est appelée courbe de Morse.
Pour réagir, une molécule doit quitter la vallée correspondant à sa géométrie initiale de réactif, pour trouver une autre vallée, correspondant à sa nouvelle forme en tant que produit de la réaction. Si plusieurs molécules entrent en réaction, la situation topologique reste la même. La ou les molécules doivent donc franchir un col pour réagir. Elles choisissent le col le plus bas qui puisse relier les deux vallées. L'existence et le rôle de ce col furent soupçonnés par Kohnstamm et Scheffer aux Pays-Bas en 1910, puis découverts et étudiés en premier par Evans et Polanyi, et séparément par Eyring en 1935. Ce dernier l'appela « état de transition ». De nos jours, les théoriciens savent calculer la géométrie détaillée de ces états de transition, qui sont en fait des structures ressemblant à des molécules très déformées, où certaines liaisons sont étirées ou même coupées.
Le paramagnétisme de la molécule d'oxygène
En très grande majorité, les molécules sont neutres au point de vue magnétique. Placées dans un champ magnétique externe, elles développent seulement un petit moment magnétique induit qui s'oppose à la direction du champ. Cependant, certaines molécules se comportent comme de véritables petits aimants : elles possèdent un moment magnétique permanent. C'est le cas de la molécule d'oxygène O2 : un récipient d'oxygène liquide placé en équilibre sur le plateau d'une balance fait pencher celle-ci si on approche un aimant. Cette aimantation permanente des molécules d'oxygène, dont l'effet au niveau microscopique est de renforcer le champ externe, s'appelle paramagnétisme. Un des premiers grands succès de la méthode des orbitales moléculaires a été l'explication de ce paramagnétisme.
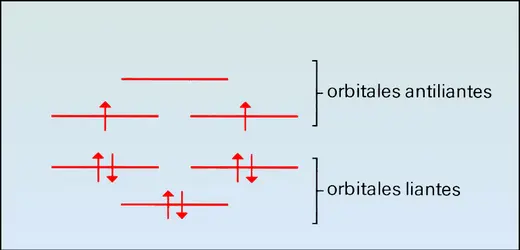
La molécule O2 contient 16 électrons, chacun des atomes d'oxygène en fournissant 8. Ces 16 électrons entrent dans les orbitales moléculaires liantes, en commençant par les plus basses. Si on laisse de côté les deux électrons très profonds de type 1s de la couche interne de chaque atome (quatre en tout), et les électrons demi-profonds de type 2s, aussi au nombre de deux par atome (quatre en tout), il reste huit électrons à placer. À partir des orbitales atomiques 2px, 2py, 2pz des deux atomes, on peut former trois orbitales moléculaires liantes et trois orbitales antiliantes. Six électrons entrent dans les orbitales moléculaires liantes. Il reste encore deux électrons ; bon gré mal gré, ceux-ci entrent dans les orbitales antiliantes, dont il se trouve que les deux plus basses ont la même énergie. D'après la règle de Hund, les deux électrons doivent occuper chacun une orbitale, en gardant leurs spins[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Lionel SALEM : Directeur de recherche au C.N.R.S., laboratoire de chimie théorique de l'université de Paris-Sud.
- François VOLATRON : professeur agrégé, docteur d'Etat chargé de recherche au CNRS
Classification
Médias
Autres références
-
CHIMIE - Histoire
- Écrit par Élisabeth GORDON , Jacques GUILLERME et Raymond MAUREL
- 11 189 mots
- 7 médias
Quantà la chimie théorique – qui étudie les molécules, leurs propriétés, leurs interactions par les méthodes de la chimie quantique ainsi que par des méthodes stochastiques –, elle joue un rôle important dans tous les domaines de la chimie. Ses progrès, favorisés par l'apparition de calculateurs de... -
EYRING HENRY (1901-1981)
- Écrit par Georges BRAM et Encyclopædia Universalis
- 460 mots
Le physico-chimiste américain Henry Eyring est né le 20 février 1901 à Colonia Juárez, au Mexique. En 1912, sa famille est expulsée du pays par les insurgés et s’installe en Arizona – Eyring deviendra citoyen américain en 1935. Il commence ses études supérieures à l'université d'Arizona où il obtient...
-
KOHN WALTER (1923-2016)
- Écrit par Bernard PIRE
- 449 mots
Physicien théoricien de la matière condensée, Prix Nobel de chimie en 1998, Walter Kohn a fait progresser la compréhension de la structure électronique des atomes, des molécules et des matériaux solides. L'application de sa méthode originale a permis des avancées spectaculaires en physique, en chimie...
-
LIAISONS CHIMIQUES - Liaison et classification
- Écrit par André JULG
- 8 250 mots
- 7 médias
Le problème de la nature de la liaison chimique s'est posé dès que fut entrevue la structure discontinue de la matière. Depuis l'Antiquité, chaque époque s'y est intéressée, proposant des solutions adaptées à ses connaissances. Démocrite munissait les particules de petits crochets afin de leur permettre...
- Afficher les 7 références
Voir aussi
- BUTADIÈNE
- LEWIS THÉORIE DE
- RÉACTIONNELS MÉCANISMES
- ORBITALES ATOMIQUES
- PARAMAGNÉTISME
- DÉLOCALISATION ÉLECTRONIQUE
- HAMILTONIEN
- SCHRÖDINGER ÉQUATION DE
- TRANSITION ÉTAT DE
- MOLÉCULES DIATOMIQUES
- COVALENTE LIAISON
- PI ORBITALE
- ORBITALES MOLÉCULAIRES
- ORBITALES LIANTES
- FONCTION D'ONDE
- HÜCKEL RÈGLE DE
- ORBITALES ANTILIANTES
- COUCHES ÉLECTRONIQUES
- HUND RÈGLE DE
- ÉNERGIE POTENTIELLE
- LIAISONS DE VALENCE MÉTHODE DES
- QUANTIQUE MÉCANIQUE
- PAULI PRINCIPE D'EXCLUSION DE
- ÉLECTRONIQUE STRUCTURE
- NIVEAU, physique atomique
- STABILITÉ, chimie
- CHIMIE HISTOIRE DE LA
- BORN & OPPENHEIMER APPROXIMATION DE
- HARTREE-FOCK ÉQUATION DE
- IONIQUE LIAISON
- FUKUI KENICHI (1918-1998)
- FERROCÈNE
- WOODWARD & HOFFMANN RÈGLES DE
- MOMENT MAGNÉTIQUE