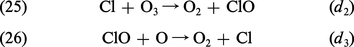CHLORE
Article modifié le
État naturel et historique de la fabrication
Le chlore, sous forme de chlorures, est le plus abondant (0,2 p. 100 de l'écorce terrestre) des halogènes. L'évaporation de l'eau de mer fournit par litre 28,5 g de chlorure de sodium. 4,8 g de chlorure de magnésium et 0,8 g de chlorure de potassium. Les dépôts de sel gemme proviennent de l'évaporation d'anciennes mers ; quand les espaces asséchés sont restés, durant l'évaporation, en relation avec le large, les sels les plus solubles ne se sont pas déposés et l'on trouve uniquement du chlorure de sodium avec du sulfate de calcium (gisement de Lorraine) ou éventuellement du chlorure de potassium (Alsace) ; lorsqu'il s'agit de l'évaporation d'une mer fermée à partir de laquelle tous les sels se sont déposés, les dépôts sont beaucoup plus complexes : on trouve alors des sels de potassium et de magnésium, comme à Stassfurt.
C'est le Suédois C. W. Scheele qui, dès 1774, découvrit le chlore par action de l'acide chlorhydrique sur le bioxyde de manganèse : on le considérait comme l'acide marin (HCl) déphlogistiqué, c'est-à-dire contenant de l'oxygène ; ce n'est qu'après de longues discussions entre L. J. Gay-Lussac, L. J. Thenard et H. Davy qu'il fut défini comme un élément, auquel Davy donna le nom de chlore (1810), à cause de sa couleur verte (du grec κλωρ́ος, vert). L'histoire de la préparation industrielle, apparue au début du xixe siècle, est marquée par quatre périodes :
1. Alors que le procédé Leblanc se développe, la découverte des chlorures décolorants par Berthollet conduit les soudières à intégrer à la fabrication du carbonate de sodium celle de ces nouveaux produits, afin d'éviter de répandre dans l'atmosphère des quantités de plus en plus grandes d'acide chlorhydrique résultant de la première phase du procédé Leblanc. Ce produit est transformé en chlore, d'abord par le procédé Scheele, amélioré par W. Weldon, puis, vers 1870, par le procédé Deacon utilisant la réaction équilibrée :
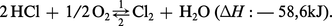
Cette réaction, exothermique dans le sens 1, exigeait d'opérer à la température minimale compatible avec une vitesse de réaction suffisante. À 450 0C, en présence de chlorure cuivrique comme catalyseur, on parvenait à transformer 47 p. 100 de l'acide chlorhydrique. La sévérité de la législation anglaise (Alkali Act de 1863) obligeant les soudières à ne plus déverser dans l'atmosphère l'acide chlorhydrique formé, donc à le transformer en chlore, explique l'importance prise en Grande-Bretagne par l'industrie des chlorures décolorants.
2. À partir du début du xxe siècle, l' électrolyse du chlorure de sodium en solution aqueuse, qui fournit du chlore à l'anode et de la soude et de l'hydrogène à la cathode, est venue concurrencer ce procédé et cela d'autant plus que, par suite du déclin du procédé Leblanc, on disposait de moins d'acide chlorhydrique résiduaire.
La mise au point industrielle de la liquéfaction du chlore en Allemagne avant la Première Guerre mondiale, en facilitant le transport du chlore, donc la fabrication des chlorures décolorants sur le lieu de leur utilisation, allait favoriser cette nouvelle technique.
En France, les chemins de fer s'étaient opposés au transport du chlore liquide. Ce n'est qu'en 1915, après que les Allemands eurent utilisé ce produit comme gaz de combat, qu'on développa l'électrolyse pour obtenir le chlore qu'exigeait la défense nationale.
3. Après 1918, la paix revenue, certains doutaient que les ateliers d'électrolyse ainsi créés puissent trouver la possibilité de placer leurs produits. Or, par suite du développement de la fabrication de la soie artificielle, les besoins en soude augmentèrent considérablement ; simultanément,[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Henri GUÉRIN : ingénieur de l'École supérieure de physique et chimie industrielles, professeur honoraire de l'université de Paris-XI
Classification
Médias
Autres références
-
ARMES - Armes lourdes
- Écrit par Alain BRU
- 3 927 mots
- 2 médias
...avril 1915, près d'Ypres, la première attaque chimique massive ; elle fit environ dix mille morts ou hommes hors de combat. Il s'agissait de vapeur de chlore. La suite du conflit connut une « course » parallèle aux produits plus toxiques, mais aussi aux équipements protecteurs. Les effets létaux furent... -
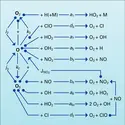
ATMOSPHÈRE - Chimie
- Écrit par Marcel NICOLET
- 3 554 mots
- 5 médias
-
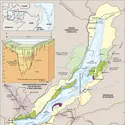
BAÏKAL LAC
- Écrit par Laure ARJAKOVSKY et Pierre CARRIÈRE
- 4 074 mots
- 2 médias
...la quantité des sulfates était passée de 330 000 tonnes par an en 1962 à 470 000 tonnes par an en 1992 ; pour la même période, le taux des dérivés du chlore a augmenté de 49 000 à 69 000 tonnes par an, et les matières organiques sont passées de 500 000 à 790 000 tonnes par an. S'agissant de la pollution... -
BERTHOLLET CLAUDE LOUIS (1748-1822)
- Écrit par Michelle GOUPIL-SADOUN
- 1 193 mots
...édition en 1804, l'ouvrage de Berthollet resta longtemps le manuel des ouvriers en teinture. Il découvrit aussi le procédé du blanchiment des toiles par le chlore. La chimie industrielle lui doit enfin des études importantes sur la fabrication et la nature des aciers, qu'il réalisa en 1786 avec Vandermonde... - Afficher les 23 références
Voir aussi
- SOUDE (hydroxyde de sodium)
- PHOSGÈNE (oxychlorure de carbone)
- BIOXYDE DE CHLORE
- MINÉRALE CHIMIE
- CHIMIQUES SUBSTANCES, écotoxicologie
- EAU DE JAVEL (hypochlorite de sodium)
- CHIMIQUES INDUSTRIES
- CHLORURE DE SODIUM
- CATHODE
- ANODE
- DISMUTATION, chimie
- LEBLANC PROCÉDÉ
- SEL GEMME
- HOOKER CELLULE
- GAZ DE COMBAT
- DEACON PROCÉDÉ
- DIAPHRAGME PROCÉDÉ AU
- MERCURE CELLULES À CATHODE DE
- PECHINEY CELLULE
- CHLORHYDRIQUE ACIDE
- FLUIDES FRIGORIGÈNES
- ÉLECTROLYSE
- CAOUTCHOUCS SYNTHÉTIQUES
- EAU APPROVISIONNEMENT ET TRAITEMENT DE L'