CHROME
Propriétés
Caractéristiques physiques et mécaniques
Le chrome est un métal blanc grisâtre, dur ; par électrolyse, on obtient des dépôts brillants. Il existe plusieurs isotopes : 38, 48, 49, 50, 51, 52, 53, 54 et 55 ; les isotopes 49, 51 et 55 sont radioactifs. L'état électronique fondamental est 1s2 ; 2s2, 2p6 ; 3s2, 3p6, 3d5 ; 4s1.
Les principales constantes physiques et mécaniques sont réunies dans le tableau.
Propriétés chimiques
À la température ordinaire, le chrome résiste à l'air sec ou humide, à l'eau de pluie ou à l'eau de mer et à divers agents chimiques ; d'où l'intérêt du chromage. Il absorbe l'hydrogène, mais les hydrures déjà mentionnés sont des composés d'insertion.
Vers 600 0C, tous les halogènes, le fluorure et le chlorure d'hydrogène réagissent sur le chrome. Vers 2 000 0C, ce métal brûle dans l'oxygène en donnant l' oxyde Cr2O3 ; il décompose la vapeur d'eau au rouge vif ; il est sulfuré par la vapeur de soufre à 700 0C et par l'hydrogène sulfuré à 1 200 0C. Le chrome fondu dissout jusqu'à 4 p. 100 de son poids d'azote ; l'ammoniac, à 850 0C, donne un nitrure et l'oxyde NO, au rouge, un mélange de nitrure et d'oxyde.
À haute température, le chrome se combine avec le phosphore, le carbone, le silicium, le bore ; on a fait intervenir dans le diagramme chrome-carbone les combinaisons Cr3C2, Cr7C2 et Cr23C6.
En solution aqueuse étendue, les hydracides halogénés, l'acide sulfurique et, plus difficilement, l'acide acétique attaquent le chrome à froid avec dégagement d'hydrogène et production d'un sel de chrome (II). L'acide sulfurique concentré et bouillant réagit avec dégagement d'anhydride sulfureux. À l'inverse, l'acide nitrique concentré, l'eau de chlore, les acides H3PO4, HClO3, HClO4 rendent le chrome passif et, par conséquent, inattaquable par les acides étendus ; on attribue cette passivité soit à une pellicule continue d'oxyde, soit à une adsorption d'oxygène ; elle peut être détruite par action de l'hydrogène à chaud ou de divers réducteurs.
Les alcalis fondus attaquent le chrome au rouge, tandis que les carbonates alcalins sont sans action.
Le chrome pulvérisé catalyse certaines réactions : réduction de CO2 en CO par l'hydrogène, réaction du méthane sur la vapeur de soufre avec production de sulfure de carbone, en particulier.
Propriétés physiologiques : toxicologie
Le métal lui-même n'est pas toxique, mais les sels de chrome trivalent et surtout l'acide chromique et ses sels sont des poisons. Les cations Cr3+ se fixent sur l'hémoglobine et les protéines du plasma. L'acide chromique, les bichromates et les chromates attaquent la peau et les voies respiratoires, provoquant des ulcères, des dermatoses, de l'irritation chronique, de graves lésions telles que la perforation de la cloison nasale. Pour l'homme, la dose mortelle de bichromate de potassium, poison méthémoglobinisant, est de 0,25 à 0,30 g. Les chromates jouissent de propriétés bactéricides.
Données analytiques
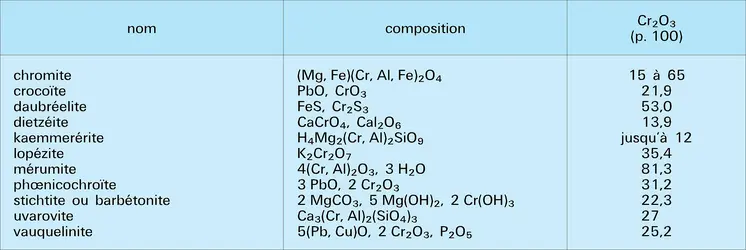
Les composés du chrome donnent, avec le borax, une perle verte. La fusion avec du carbonate de sodium au contact de l'air, ou mieux avec un nitrate alcalin, fournit une masse colorée en jaune par le chromate formé. En solution, les cations Cr3+ donnent avec les bases un précipité verdâtre d'oxyde Cr2O3 hydraté et ne précipitent pas par l'hydrogène sulfuré, alors que les chromates donnent une coloration violette avec la diphénylcarbazide, et, avec l'eau oxygénée, une coloration bleue, que l'on peut rassembler dans quelques gouttes d'éther. Dans ce dernier cas, les perchromates bleus contiennent du chrome à l'état d'oxydation 6.
Pour effectuer les dosages gravimétriques, le chrome est précipité, soit[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean AMIEL : ancien élève de l'École nationale supérieure de physique et de chimie de Paris, agrégé de physique, professeur honoraire de chimie générale à l'université de Paris-VI-Pierre-et-Marie-Curie
Classification
Médias
Autres références
-
ACIER - Technologie
- Écrit par Louis COLOMBIER , Gérard FESSIER , Guy HENRY et Joëlle PONTET
- 14 178 mots
- 10 médias
L'élément le plus fréquemment utilisé est le chrome. On le retrouve à la fois dans la ferrite et dans les carbures. Il agit, d'une part, sur les points de transformation de l'acier, d'autre part, sur la vitesse à laquelle se transforme l'austénite au cours du refroidissement. -
ALBANIE
- Écrit par Anne-Marie AUTISSIER , Odile DANIEL , Encyclopædia Universalis et Christian GUT
- 22 078 mots
- 9 médias
...Après trois années de croissance ralentie, 1979 était considérée comme la « meilleure année » du sixième plan, marqué par la rupture de l'aide chinoise. L'Albanie occupait alors le troisième rang mondial pour la production de chrome et le deuxième pour l'exportation de ce dernier. La construction de l'usine... -
ALLIAGES
- Écrit par Jean-Claude GACHON
- 7 363 mots
- 5 médias
...dits, pour cette raison, alliages interstitiels. À côté des aciers fer-carbone, on trouve des aciers « alliés », qui renferment des éléments tels que le chrome, le nickel, le manganèse... La rouille des aciers ordinaires est le plus connu des phénomènes de dégradation des alliages métalliques ; il... -
CORROSION
- Écrit par Gérard BERANGER et Jean TALBOT
- 5 145 mots
- 3 médias
- Afficher les 8 références