CHROME
Article modifié le
Composés du chrome
Le chrome possède trois degrés d'oxydation (ou états de valence) principaux : + 2 auquel correspondent les sels chromeux, réducteurs énergiques, + 3 que l'on rencontre dans de nombreux sels et complexes chromiques et dans les chromites et + 6 qui est représenté par des oxydants, les chromates et les polychromates.
Il faut cependant signaler cinq états d'oxydation inhabituels : − 2 dans l'hydrure de chrome carbonyle H2[Cr(CO)5], 0 dans le chrome hexacarbonyle Cr(CO)6 à structure octaédrique ou dans le chrome dibenzène Cr(C6H6)2 qui a une structure en sandwich, + 1 dans le perchlorate de chrome bis-α, α′-dipyridyle, + 4 dans l'oxyde CrO2, dans K2[CrF6]ou dans Ba2[CrO4], + 5 dans K2[CrOCl5]ou dans Na3CrO4.
Sels chromeux
Les sels de chrome (II), ou sels chromeux, sont préparés en attaquant le métal par un acide non oxydant, à l'abri de l'air, ou bien par double décomposition à partir du chlorure ou du sulfate ; ils sont paramagnétiques et absorbent rapidement l'oxygène de l'air. Citons : l'oxyde CrO ; l'hydroxyde Cr(OH)2, jaune ; les halogénures CrF2 et CrCl2 ainsi que CrCl2,4 H2O ; le sulfite CrSO3,7 H2O, bleu, isomorphe du sulfate ferreux heptahydraté ; l'acétate [Cr(OCOCH3)2]2,2 H2O, dimère, diamagnétique, plus stable, rouge.
Sels chromiques
Les sels de chrome (III) résultent de l'oxydation des sels chromeux ou de la réduction des chromates en milieu acide. Ils sont stables à l'air, paramagnétiques et donnent un très grand nombre de complexes hexacoordinés qui possèdent eux aussi trois électrons célibataires (d'où un moment magnétique voisin de 3,87 magnétons de Bohr).
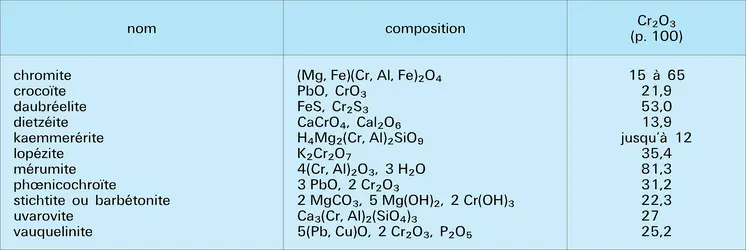
Le sesquioxyde Cr2O3 provient de la réduction d'un bichromate alcalin par le soufre, la sciure de bois ou divers composés organiques, le toluène en particulier. On peut aussi calciner l'hydroxyde Cr(OH)3, précipité vert qui est en réalité un oxyde hydraté et non un hydroxyde. Cr2O3 est rhomboédrique, vert foncé ; c'est un oxyde amphotère qui se dissout dans les acides en donnant les sels de chrome (III) et qui réagit à chaud sur les oxydes métalliques en fournissant des chromites ; parmi ces dernières, citons la chromite de fer, cristaux cubiques du type spinelle ; on peut obtenir certaines chromites en solution, mais elles sont généralement très hydrolysables.
En solution, les ions Cr3+ ont tendance à se dissimuler dans les structures complexes : soit dans des anions, comme le fer et l'aluminium ; soit dans des cations, comme le cobalt ou le platine. La série des chromiammines, par exemple, est analogue à celle des cobaltiammines. La coordination est presque toujours égale à 6 et la structure octaédrique.
L'ion [Cr(H2O)6]3+ est violet et on le trouve dans les solutions aqueuses ou dans les sels chromiques hydratés. Les sels violets solides chauffés deviennent verts ; leurs solutions aqueuses présentent le même virage et refusent alors de cristalliser. Ce changement de coloration est lié à l'introduction d'anions dans l'ion complexe avec expulsion d'une partie des molécules d'eau, et il est généralement réversible. On connaît par exemple les trois chlorures : [Cr(H2O)6]Cl3, violet (Recoura, 1886) ; [CrCl(H2O)5]Cl2,H2O, vert clair (Bjerrum, 1906) ; [CrCl2(H2O)4]Cl, 2 H2O, vert foncé (Recoura, 1886).
On a préparé aussi des complexes M2[Cr(H2O)Cl5]rouges ou violets et M3[CrCl6]violets, M étant un alcalin.
Citons comme sels chromiques :
– les halogénures : CrF3 vert et [Cr(H2O6]F3 violet, CrCl3 couleur « fleur de pêcher » sublimable vers 1 100 0C et [Cr(H2O)6]Cl3 violet, CrBr3 et [Cr(H2O)6]Br3, [Cr(H2O)6]I3, 3H2O ;
– le sulfate anhydre Cr2(SO4)3 rouge bleuâtre insoluble dans l'eau et l'hydrate Cr2(SO4)3,17 H2O violet, formulé aussi [Cr(H2O)6]2(SO4)3,5 H2O, obtenu en dissolvant l'oxyde[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean AMIEL : ancien élève de l'École nationale supérieure de physique et de chimie de Paris, agrégé de physique, professeur honoraire de chimie générale à l'université de Paris-VI-Pierre-et-Marie-Curie
Classification
Médias
Autres références
-
ACIER - Technologie
- Écrit par Louis COLOMBIER , Gérard FESSIER , Guy HENRY et Joëlle PONTET
- 14 178 mots
- 10 médias
L'élément le plus fréquemment utilisé est le chrome. On le retrouve à la fois dans la ferrite et dans les carbures. Il agit, d'une part, sur les points de transformation de l'acier, d'autre part, sur la vitesse à laquelle se transforme l'austénite au cours du refroidissement. -
ALBANIE
- Écrit par Anne-Marie AUTISSIER , Odile DANIEL , Encyclopædia Universalis et Christian GUT
- 22 078 mots
- 9 médias
...Après trois années de croissance ralentie, 1979 était considérée comme la « meilleure année » du sixième plan, marqué par la rupture de l'aide chinoise. L'Albanie occupait alors le troisième rang mondial pour la production de chrome et le deuxième pour l'exportation de ce dernier. La construction de l'usine... -
ALLIAGES
- Écrit par Jean-Claude GACHON
- 7 363 mots
- 5 médias
...dits, pour cette raison, alliages interstitiels. À côté des aciers fer-carbone, on trouve des aciers « alliés », qui renferment des éléments tels que le chrome, le nickel, le manganèse... La rouille des aciers ordinaires est le plus connu des phénomènes de dégradation des alliages métalliques ; il... -
CORROSION
- Écrit par Gérard BERANGER et Jean TALBOT
- 5 145 mots
- 3 médias
- Afficher les 8 références
Voir aussi