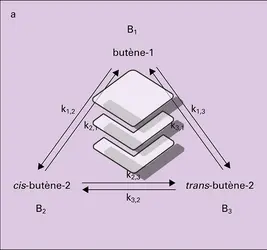
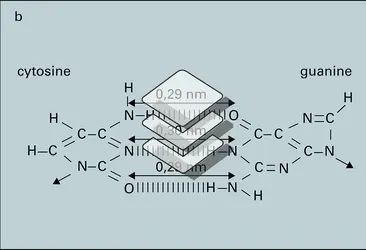
CINÉTIQUE CHIMIQUE
Localisation de la transformation chimique
Une donnée importante sur la transformation chimique est sa localisation. Il y a d'ailleurs lieu tout d'abord de réexaminer la notion de système chimique : celui-ci est défini comme un certain volume de matière que l'on doit pouvoir, pour l'étudier en tant que tel, limiter par une enveloppe dont de préférence l'interaction chimique avec le système est nulle. Cela est possible assez souvent pour des systèmes évoluant à température faible grâce à des matériaux inertes, verre, « inox », voire titane. Quand cela n'est pas possible, et c'est le cas général pour les hautes températures parce que les parois « réfractaires » sont souvent chimiquement impliquées dans le système, on doit choisir une frontière fictive du système, frontière au travers de laquelle on devra mesurer les transferts de matière relatifs à tous les constituants chimiques du système ; c'est le cas par exemple des fronts de flamme ou des réactions dans les plasmas ionisés, systèmes chimiques où l'on parvient à réaliser des températures de 3 000 0C ou largement supérieures.
Il est également primordial pour la conception des mesures, et pour l'interprétation des résultats, de savoir si la réaction se produit ou non de manière uniforme dans une phase homogène. Une telle réaction est dite homogène au sens strict. Ce cas est très favorable, puisque la mesure, en un point, informe sur l'ensemble, et on essaiera de le réaliser dans les études en laboratoire bien qu'il soit en fait assez exceptionnel dans la pratique. En effet, même dans des systèmes ne comportant qu'une seule phase au sens physico-chimique du terme, les écarts de composition seront souvent tels que, du point de vue cinétique, il faudra l'étudier comme un système non uniforme, c'est-à-dire déterminer l'état et les concentrations des espèces chimiques en tout point du système. Tel est le cas pour l'évolution d'une masse gazeuse ou liquide si la réaction est initiée, ou inhibée, par la paroi du récipient, phénomène fréquent qui se traduit par la sensibilité de ces systèmes à la nature des parois ; par exemple, la décomposition d'eau oxygénée est très sensible au matériau de stockage utilisé.
Les systèmes hétérogènes sont les plus fréquents, la quantité des cas possibles étant très grande par le nombre et la nature des phases présentes, le degré d'uniformité de chacune d'elles, et surtout par la variété des facteurs cinétiques qui exercent leur influence en tout point du système. Un cas souvent rencontré est celui d'un système biphasique liquide-gaz ; la réaction sera homogène dans chacune des phases, pour autant que l'équilibre de composition entre les phases puisse être assuré en permanence. Lorsque les phénomènes de transfert de matière à l'interface deviennent trop lents, il se produit des gradients de concentration à son voisinage et le phénomène est plus complexe à suivre. L'étude des réactions hétérogènes devient plus délicate encore si, outre les phases fluides, il intervient une ou plusieurs phases solides. Le comportement de ces phases solides sera déterminé dans une large mesure par leur structure et leur texture, mais aussi par les caractéristiques de l'interface qui peut, lui, être affecté par des imperfections du réseau du solide, et qu'il faudrait pouvoir connaître au niveau même de la position des atomes ; or, les méthodes physiques sont disponibles pour connaître les compositions ou les caractéristiques structurales des phases, mais sont souvent insuffisantes pour les études de surface. Dans le cas, très fréquent en chimie organique industrielle, où le système chimique est constitué par une phase fluide dont la transformation est catalysée par un solide, la difficulté est de nature[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Lucien SAJUS : Docteur ès sciences, ingénieur en chef des Mines, directeur général de la Compagnie française d'études et onstruction Technip.
Classification
Médias
Autres références
-
ACTIVITÉ, chimie
- Écrit par Dina SURDIN
- 260 mots
Grandeur introduite par G. N. Lewis, en 1907, pour exprimer les propriétés thermodynamiques des solutions. En effet, l'expression du potentiel chimique d'un composé dans une solution idéale, donné par la relation μ = kT ln N + μ0, où N représente la fraction molaire du composé,...
-
ANTIOXYGÈNES
- Écrit par Robert PANICO
- 2 341 mots
- 2 médias
Du point de vue de la cinétique, la réaction d'autoxydation est caractérisée par l'existence d'une période d'induction au début de la réaction, au cours de laquelle la vitesse est pratiquement négligeable. La vitesse de la réaction croît ensuite rapidement puis se stabilise. -
CATALYSE
- Écrit par Henri Jean-Marie DOU et Jean-Eugène GERMAIN
- 8 396 mots
- 7 médias
Lacinétique des réactions catalysées est dominée par la vitesse de réaction des centres actifs avec les corps de départ ou la vitesse de libération de ces centres par désorption des produits ; ces deux vitesses étant égales lorsque s'est établi le régime stationnaire, l'étape la plus lente gouverne... -
COORDINATION (chimie) - Composés de coordination
- Écrit par Jean AMIEL et Jean-Pierre SCHARFF
- 4 895 mots
- 4 médias
Du point de vuecinétique, les complexes inertes présentent des réactions suffisamment lentes pour être étudiées par les techniques conventionnelles. Par contre, pour les complexes labiles (temps de demi-réaction de 10-8 à une seconde), seul le développement de techniques spéciales, telles que... - Afficher les 20 références