CINÉTIQUE CHIMIQUE
Article modifié le
Formes réelles des espèces chimiques
Constituer un système chimique, par mélange de plusieurs composés chimiques, est considéré, si les espèces chimiques demeurent récupérables par fractionnement du système, comme une simple opération physique ; en fait, il se produit souvent une organisation entre les molécules des espèces chimiques engagées, véritable transformation chimique conduisant à de nouvelles espèces ; c'est parce que cette transformation est aisément réversible qu'elle est annulée lors du fractionnement du système et que l'on a eu tendance à la négliger alors qu'elle est d'une grande importance pour comprendre les transformations chimiques que subirait le système si on l'activait. L'étude in situ des systèmes chimiques, sans isolement des constituants chimiques, rendue possible par le développement des méthodes spectroscopiques (infrarouge, ultraviolet, résonance magnétique nucléaire, résonance paramagnétique électronique) a permis l'étude de ces formes.
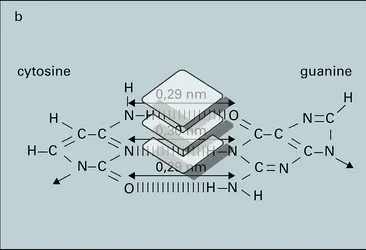
Ainsi un composé salin AB, chlorure de sodium par exemple, est sous forme cristalline une organisation structurée d'ions Cl- et Na+. Mis en solution dans l'eau, ces ions seront rendus indépendants, mais tous seront solvatés par des molécules d'eau (Cl-, nH2O) et (Na+, n′H2O). Dans un solvant organique, de constante diélectrique plus faible que l'eau, l'alcool par exemple, les ions se neutraliseront deux à deux et seront toujours couplés à l'état de paire d'ions (Cl-, Na+). De même l'acide acétique, CH3CO2H, existe le plus souvent sous forme auto-associée, à l'état de dimères ouverts ou fermés correspondant aux structures décrites dans la figure. Ces formes, en équilibre entre elles, représentent la nature réelle de l'espèce chimique dans un système qui peut être inerte ou réactif. Dans ce dernier cas, la commutation des liaisons interatomiques que suppose la transformation irréversible des espèces s'opère par des modes variés, mais nécessite le passage des réactifs par des formes intermédiaires, parfois extrêmement fugaces, et de ce fait présentes en très faible concentration dans le système. La nature de ces formes actives, qui peuvent être, dans des cas de plus en plus nombreux, observées in situ dans le système en évolution, confère à la transformation certains de ces caractères marquants. On distingue quatre types principaux de formes actives.
Les molécules activées
L' état normal d'une molécule correspond à la structure et à la configuration électronique conduisant à l'énergie la plus faible. Si un électron, qui dans l'état stable occupe une certaine orbitale, est promu sur une orbitale de plus haute énergie, la molécule sera activée, c'est-à-dire moins stable ou plus réactive. Ainsi l'oxygène peut exister sous plusieurs formes activées ; alors que la forme stable a une configuration électronique où les deux électrons de plus haute énergie ont des spins parallèles (état triplet), beaucoup de réactions supposent que l'oxygène passe par une forme activée où ces deux électrons ont des spins antiparallèles (état singulet). Ces états activés se décèlent surtout par spectroscopie ultraviolette ou par mesure des caractéristiques magnétiques.
Les radicaux
Certaines formes actives résultent de la scission d'une molécule, chaque fragment conservant un électron du couple d'électrons qui assurait la liaison dans la molécule ; c'est une scission homolytique donnant deux radicaux, comportant chacun un électron non apparié. De tels radicaux sont extrêmement réactionnels et permettent en particulier des mécanismes en chaîne. La scission qui les crée est provoquée thermiquement, photochimiquement ou par un initiateur chimique. Ils ont été détectés par les conséquences logiques de la cinétique chimique ; aujourd'hui, la résonance paramagnétique[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Lucien SAJUS : Docteur ès sciences, ingénieur en chef des Mines, directeur général de la Compagnie française d'études et onstruction Technip.
Classification
Médias
Autres références
-
ACTIVITÉ, chimie
- Écrit par Dina SURDIN
- 260 mots
Grandeur introduite par G. N. Lewis, en 1907, pour exprimer les propriétés thermodynamiques des solutions. En effet, l'expression du potentiel chimique d'un composé dans une solution idéale, donné par la relation μ = kT ln N + μ0, où N représente la fraction molaire du composé,...
-
ANTIOXYGÈNES
- Écrit par Robert PANICO
- 2 341 mots
- 2 médias
Du point de vue de la cinétique, la réaction d'autoxydation est caractérisée par l'existence d'une période d'induction au début de la réaction, au cours de laquelle la vitesse est pratiquement négligeable. La vitesse de la réaction croît ensuite rapidement puis se stabilise. -
CATALYSE
- Écrit par Henri Jean-Marie DOU et Jean-Eugène GERMAIN
- 8 396 mots
- 7 médias
Lacinétique des réactions catalysées est dominée par la vitesse de réaction des centres actifs avec les corps de départ ou la vitesse de libération de ces centres par désorption des produits ; ces deux vitesses étant égales lorsque s'est établi le régime stationnaire, l'étape la plus lente gouverne... -
COORDINATION (chimie) - Composés de coordination
- Écrit par Jean AMIEL et Jean-Pierre SCHARFF
- 4 895 mots
- 4 médias
Du point de vuecinétique, les complexes inertes présentent des réactions suffisamment lentes pour être étudiées par les techniques conventionnelles. Par contre, pour les complexes labiles (temps de demi-réaction de 10-8 à une seconde), seul le développement de techniques spéciales, telles que... - Afficher les 20 références
Voir aussi
- IONS
- RÉACTIONNELS MÉCANISMES
- ISOTOPIQUES EFFETS
- RÉACTIF, chimie
- COLLISION, physique
- HOMOGÉNÉITÉ
- CATALYSEURS
- VITESSE DE RÉACTION
- CHIMIQUES INDUSTRIES
- ACTIVATION, chimie
- RÉSONANCE PARAMAGNÉTIQUE ÉLECTRONIQUE (RPE)
- RÉACTIVITÉ ÉCHELLE DE
- THERMODYNAMIQUE CHIMIQUE
- ÉNERGIE POTENTIELLE
- CONCENTRATION, chimie
- INITIATEUR, chimie
- RÉACTION EN CHAÎNE, chimie
- TEMPÉRATURE
- MÉTASTABILITÉ, chimie physique
- CONFIGURATION ÉLECTRONIQUE
- CHIMIE HISTOIRE DE LA
- HÉTÉROGÉNÉITÉ
- PHASES, physico-chimie
- MODÉLISATION
- TRANSFORMATION RÉVERSIBLE
- MODÈLE, chimie