CINÉTIQUE CHIMIQUE
Cinétique formelle
La description de l'évolution du phénomène chimique doit être poussée jusqu'à pouvoir être quantitative. Après que la nature des constituants a été identifiée, les mesures quantitatives qui serviront à décrire le système sont des mesures de nombre de molécules dans le système, Ni pour un constituant i.
Les données fondamentales pour la description en cinétique chimique des phénomènes sont des vitesses d'apparition ou de disparition des constituants par unité de temps et de volume (V désigne le volume du système considéré) :
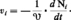
Dans le cas d'un système homogène au sens strict, vi sera identique en tout point et ne dépendra donc que du système et des paramètres physiques globaux, température et pression. Dans les autres cas, il faudra être en mesure de connaître vi en tout point du système soit vi(x, y, z), la vitesse vi moyenne n'étant que l'intégrale étendue au volume du système des vitesses locales :
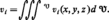
Le cas d'un système isochore sera également plus facile à étudier que celui d'un système évoluant à volume variable.
La réaction isolée
L'étude sera surtout beaucoup plus facile si l'on est en présence d'une réaction chimique isolée, c'est-à-dire conduisant à un système unique de produits stœchiométriquement liés. Dans ce cas, en effet, les vitesses relatives aux réactifs ou aux produits seront proportionnelles entre elles et il suffira d'en étudier plus spécialement une, celle qui est relative au constituant le plus facile à doser, pour définir la vitesse de la réaction :

L'objet de la cinétique formelle est de préciser l'influence quantitative de tous les facteurs mesurables sur la vitesse de réaction. Ces facteurs sont en premier lieu les concentrations des constituants, réactifs, produits, catalyseurs... Utilisant les mesures simultanées de la vitesse et des concentrations, on essaiera de déterminer la loi mathématique, dans ce cas une équation différentielle, traduisant au mieux les observations. Quand la réaction isolée est une réaction élémentaire, c'est-à-dire une réaction qui ne comporte qu'un réarrangement chimique, cette loi sera très simple, par exemple :
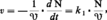
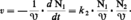
De tels cas sont en fait rares. Par analogie, cependant, on a souvent tendance à adopter a priori une expression de la vitesse qui soit une fonction puissance par rapport à chacun des constituants :


La vitesse de la réaction sera également étudiée en fonction de la température du système.[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Lucien SAJUS : Docteur ès sciences, ingénieur en chef des Mines, directeur général de la Compagnie française d'études et onstruction Technip.
Classification
Médias
Autres références
-
ACTIVITÉ, chimie
- Écrit par Dina SURDIN
- 260 mots
Grandeur introduite par G. N. Lewis, en 1907, pour exprimer les propriétés thermodynamiques des solutions. En effet, l'expression du potentiel chimique d'un composé dans une solution idéale, donné par la relation μ = kT ln N + μ0, où N représente la fraction molaire du composé,...
-
ANTIOXYGÈNES
- Écrit par Robert PANICO
- 2 339 mots
- 2 médias
Du point de vue de la cinétique, la réaction d'autoxydation est caractérisée par l'existence d'une période d'induction au début de la réaction, au cours de laquelle la vitesse est pratiquement négligeable. La vitesse de la réaction croît ensuite rapidement puis se stabilise. -
CATALYSE
- Écrit par Henri Jean-Marie DOU et Jean-Eugène GERMAIN
- 8 394 mots
- 7 médias
La cinétique des réactions catalysées est dominée par la vitesse de réaction des centres actifs avec les corps de départ ou la vitesse de libération de ces centres par désorption des produits ; ces deux vitesses étant égales lorsque s'est établi le régime stationnaire, l'étape la plus lente gouverne... -
COORDINATION (chimie) - Composés de coordination
- Écrit par Jean AMIEL et Jean-Pierre SCHARFF
- 4 894 mots
- 4 médias
Du point de vue cinétique, les complexes inertes présentent des réactions suffisamment lentes pour être étudiées par les techniques conventionnelles. Par contre, pour les complexes labiles (temps de demi-réaction de 10-8 à une seconde), seul le développement de techniques spéciales, telles que... - Afficher les 20 références