CINÉTIQUE CHIMIQUE
Schéma et mécanisme réactionnels
La description par des équations stœchiométriques d'une transformation chimique n'en montre que l'état initial et l'état final. La cinétique doit être capable de décrire l'enchaînement des étapes chimiques menant de l'un à l'autre : c'est le schéma réactionnel ; elle cherche même à décrire comment, dans un acte chimique élémentaire, se produit l'enchaînement des liaisons : c'est le mécanisme réactionnel.
Schéma réactionnel
Le fait que les réactifs interviennent dans l'équation cinétique par des relations plus ou moins complexes, qui souvent ne sont plus représentables par un ordre, indique bien que la plupart des réactions ne se ramènent pas à un acte unique entre les diverses molécules présentes dans l'équation stœchiométrique, mais se réalisent par un enchaînement d'étapes élémentaires : cet ensemble constitue le schéma réactionnel. Lorsque la réaction se consomme en un acte unique, elle est dite élémentaire et son schéma se réduit à l'équation stœchiométrique. En raison de la faible probabilité pour des partenaires de réactions de se rencontrer, au même instant, dans une disposition géométrique adéquate et avec une énergie suffisante pour réagir, les processus élémentaires ne comportent qu'un nombre réduit de molécules libres, une, deux, et très rarement trois. D'une manière générale, une réaction impliquant plus d'espèces, réactifs, catalyseurs ou initiateurs adjuvants, s'opérera nécessairement par un schéma complexe. Il y a lieu cependant de souligner qu'une stœchiométrie simple ne supposera pas un schéma réactionnel simple ; de très nombreux cas le montrent.
Les actes chimiques élémentaires n'impliquant qu'un nombre réduit de molécules et ne modifiant qu'un nombre faible de liaisons, il s'ensuit que tout regroupement ou réarrangement de quelque importance doit se produire par une suite de processus qui ne réalisent chacun qu'une transformation minime. C'est le principe du moindre changement de structure. Ce principe s'applique aussi bien à un processus de synthèse qu'à un processus de dégradation : un édifice complexe se désagrégera lui aussi par une succession d'actes élémentaires.
Les schémas réactionnels sont innombrables, surtout dans les réactions composées et surcomposées ; nous en exposerons deux, très caractéristiques, et que l'on rencontre dans une grande majorité des réactions isolées ; ils constituent des voies indirectes pour réaliser la réaction entre deux molécules A + B → C + D.
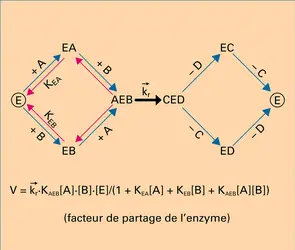
Dans le premier schéma, la réaction se décide, et les produits se forment, réellement ou potentiellement, dans une étape unique précédée, elle, par plusieurs étapes d'édification. Il trouve une illustration dans le mode d'action de certains catalyseurs. Dans les stades constructifs, généralement réversibles, le catalyseur K groupe successivement les réactifs pour édifier le complexe réactionnel qui, dans l'étape cinétique, se convertit en une association d'où les produits se dégagent chacun à son tour. Dans un tel schéma, c'est la réaction la plus lente qui constitue l'acte limitatif et règle principalement la vitesse apparente du phénomène. Si l'acte de conversion du complexe AKB est l'acte limitatif, la vitesse sera proportionnelle à sa concentration ; celle-ci n'est toutefois pas égale à la concentration analytique en catalyseur K, puisque celui-ci est engagé dans divers complexes. La concentration analytique apparaîtra dans la loi cinétique, mais réduite par une fraction, que l'on appelle facteur de partage de K entre ces diverses formes. Sans être le seul possible, ce schéma intervient dans les divers groupes de catalyses : homogène, hétérogène, enzymatique. À titre d'exemple, le schéma réactionnel de la réaction enzymatique[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Lucien SAJUS : Docteur ès sciences, ingénieur en chef des Mines, directeur général de la Compagnie française d'études et onstruction Technip.
Classification
Médias
Autres références
-
ACTIVITÉ, chimie
- Écrit par Dina SURDIN
- 260 mots
Grandeur introduite par G. N. Lewis, en 1907, pour exprimer les propriétés thermodynamiques des solutions. En effet, l'expression du potentiel chimique d'un composé dans une solution idéale, donné par la relation μ = kT ln N + μ0, où N représente la fraction molaire du composé,...
-
ANTIOXYGÈNES
- Écrit par Robert PANICO
- 2 341 mots
- 2 médias
Du point de vue de la cinétique, la réaction d'autoxydation est caractérisée par l'existence d'une période d'induction au début de la réaction, au cours de laquelle la vitesse est pratiquement négligeable. La vitesse de la réaction croît ensuite rapidement puis se stabilise. -
CATALYSE
- Écrit par Henri Jean-Marie DOU et Jean-Eugène GERMAIN
- 8 396 mots
- 7 médias
Lacinétique des réactions catalysées est dominée par la vitesse de réaction des centres actifs avec les corps de départ ou la vitesse de libération de ces centres par désorption des produits ; ces deux vitesses étant égales lorsque s'est établi le régime stationnaire, l'étape la plus lente gouverne... -
COORDINATION (chimie) - Composés de coordination
- Écrit par Jean AMIEL et Jean-Pierre SCHARFF
- 4 895 mots
- 4 médias
Du point de vuecinétique, les complexes inertes présentent des réactions suffisamment lentes pour être étudiées par les techniques conventionnelles. Par contre, pour les complexes labiles (temps de demi-réaction de 10-8 à une seconde), seul le développement de techniques spéciales, telles que... - Afficher les 20 références