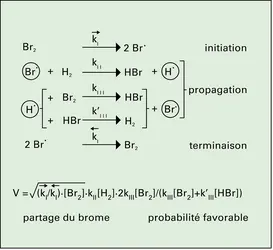
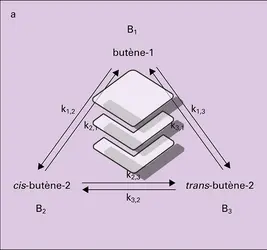
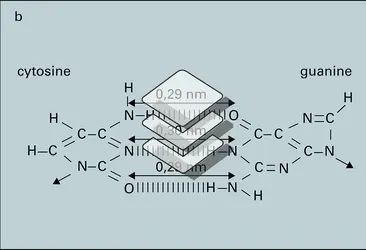
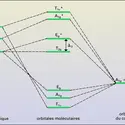
CINÉTIQUE CHIMIQUE
Structure chimique et réactivité ; échelles de réactivité
La multitude des substances chimiques, la multiplicité des systèmes réactionnels qui en dérivent donnent lieu à un nombre incalculable de réactions chimiques. Il importe donc de dégager des résultats expérimentaux des informations pour prévoir le comportement réactionnel des espèces chimiques. Si, dans un système chimique donné, on ne varie, toutes choses égales d'ailleurs, que la nature chimique d'une partie R d'un des constituants RX du système, on dit que l'on réalise une famille de réactions chimiques FI par rapport au réactif RX. On mesure alors pour chaque système de la famille la valeur de la vitesse de réaction et on dispose d'une correspondance entre la nature des réactifs modifiés (R0, R1, R2, ..., Rn) et une série de chiffres de vitesse (kI, 0, ..., kI, n). Si la réaction est élémentaire, ces valeurs doivent dépendre de façon assez directe de la nature de R. Considérons une deuxième famille de réaction FII prise, par rapport à la même suite de réactifs RY, Y étant ou non semblable à X, engagés dans un système chimique II différent du système I par exemple par la nature d'un coréactif ou du catalyseur. On mesurera une seconde série de constantes de vitesse kII, 0, ..., kII, n. Si les deux réactions élémentaires étudiées sont régies par un mécanisme assez semblable, les deux séries de chiffres pourront être reliées par une loi de similitude dont il s'agit de trouver la forme mathématique ; il faut d'abord considérer les suites de chiffres en valeur relative par rapport à l'un des termes, celui qui correspond au réactif R0 par exemple. Expérimentalement, Brönsted, puis surtout Hammett ont montré que cette loi était de la forme :
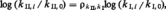
De cette constatation est venue l'idée de choisir une des suites de chiffres comme échelle d'un caractère de réactivité ; ces valeurs de base sont notées σ et il existe actuellement plusieurs échelles propres à définir ou à prévoir la réactivité des molécules dans divers types de réactions élémentaires, grâce à des lois dites, selon les cas, de Brönsted, Hammett, Taft, Brown...
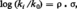
En fait, la modification de la structure d'un composé R n'affecte pas seulement sa réactivité, mais également ses autres propriétés, chimiques (aptitude à des associations ou à des dissociations) ou physiques (spectres d'absorption, infrarouge ou ultraviolet, spectre de résonance magnétique nucléaire R.M.N.). Toutes ces mesures expérimentales, quoique diverses, sont liées aux caractéristiques électroniques des composés choisis comme variables. En exprimant à nouveau ces suites de mesures en valeur relative par rapport au composé de base R0 on peut espérer trouver une similitude avec les échelles de réactivité, à condition de choisir une expression mathématique adéquate. C'est ainsi que l'expérience a permis de mettre en évidence des lois :

L'importance de ces études, qui ne progressent que lentement en raison du très grand nombre de données expérimentales nécessaires et de la difficulté à choisir les échelles σ les plus caractéristiques pour[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Lucien SAJUS : Docteur ès sciences, ingénieur en chef des Mines, directeur général de la Compagnie française d'études et onstruction Technip.
Classification
Médias
Autres références
-
ACTIVITÉ, chimie
- Écrit par Dina SURDIN
- 260 mots
Grandeur introduite par G. N. Lewis, en 1907, pour exprimer les propriétés thermodynamiques des solutions. En effet, l'expression du potentiel chimique d'un composé dans une solution idéale, donné par la relation μ = kT ln N + μ0, où N représente la fraction molaire du composé,...
-
ANTIOXYGÈNES
- Écrit par Robert PANICO
- 2 341 mots
- 2 médias
Du point de vue de la cinétique, la réaction d'autoxydation est caractérisée par l'existence d'une période d'induction au début de la réaction, au cours de laquelle la vitesse est pratiquement négligeable. La vitesse de la réaction croît ensuite rapidement puis se stabilise. -
CATALYSE
- Écrit par Henri Jean-Marie DOU et Jean-Eugène GERMAIN
- 8 396 mots
- 7 médias
Lacinétique des réactions catalysées est dominée par la vitesse de réaction des centres actifs avec les corps de départ ou la vitesse de libération de ces centres par désorption des produits ; ces deux vitesses étant égales lorsque s'est établi le régime stationnaire, l'étape la plus lente gouverne... -
COORDINATION (chimie) - Composés de coordination
- Écrit par Jean AMIEL et Jean-Pierre SCHARFF
- 4 895 mots
- 4 médias
Du point de vuecinétique, les complexes inertes présentent des réactions suffisamment lentes pour être étudiées par les techniques conventionnelles. Par contre, pour les complexes labiles (temps de demi-réaction de 10-8 à une seconde), seul le développement de techniques spéciales, telles que... - Afficher les 20 références