COMPLEXES, chimie
Différents cas de coordination
Complexes mononucléaires
Il s'agit des complexes contenant un seul ion métallique central (p = 1 dans la notation MpHqArBs). Si ces complexes comportent un seul coordinat (r ou s = 0), on obtient des complexes simples binaires du type Co(NH3)63 +, AlCl-4, Fe(CN)63-, Cr(CO)6... Dans ces cas, les méthodes classiques de détermination des constantes de stabilité ionique (par exemple : méthode de Bjerrum) s'appliquent aisément.
Chélates
Dans tous les cas, le terme complexe est remplacé par le terme chélate (du grec Khêlê, pince) lorsqu'un coordinat multidenté peut se fixer au métal par deux ou plusieurs « dents » en formant une structure cyclique dont le schéma de la figure explicite seulement quelques possibilités. De tels coordinats sont des agents chélatants. A. Werner (1901), puis H. Ley (1904) avaient déjà mentionné l'existence de certains « complexes internes » du platine et du cuivre et reconnu leur structure cyclique. C'est en 1920 que G. T. Morgan et D. H. K. Drew introduisent la terminologie plus précise et plus imagée que nous avons indiquée. Les chélates se distinguent essentiellement des autres catégories de complexes par leur grande stabilité (ionique) due à l'existence d'un (ou de plusieurs) cycle(s) dans leur structure.
L'effet chélate
L' exaltation de la stabilité d'une espèce complexe par formation d'un ou de plusieurs cycles de chélation porte le nom d'« effet chélate » (G. Schwarzenbach, 1952). Ainsi le cation complexe [Ni(NH3)2 (H2O)4]2+ (lg β ≃ 4,9) est nettement moins stable que le cation chélate [Ni en (H2O)4]2+ (lg β ≃ 7,3) dans lequel les deux coordinats monodentés NH3 ont été remplacés par un coordinat bidenté en = éthylènediamine : NH2−CH2−CH2−NH2. Il y a eu, ici, création d'un cycle à cinq maillons sur le cation Ni2+. Cet effet chélate résulte essentiellement d'un effet entropique facile à expliquer qualitativement. La formation du cation complexe provoque la disparition de deux espèces indépendantes alors que celle du cation chélate ne provoque la disparition que d'une seule espèce indépendante, induisant un accroissement relatif d'entropie pour la réaction de chélation, donc un accroissement de stabilité. Il est alors facile d'en conclure que les chélates seront d'autant plus stables que le nombre de cycles qu'ils comportent sera plus élevé ; on en trouve une confirmation dans l'extraordinaire stabilité des porphyrines (4 cycles) et dans l'aptitude particulière de l'acide éthylène-diamine-tétra-acétique (EDTA), coordinat hexadenté, à « séquestrer » fortement la plupart des ions métalliques (de 3 à 5 cycles selon la coordinence de l'ion), d'où son utilisation en complexométrie :
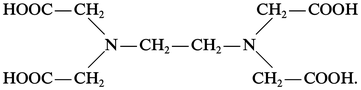
L'EDTA est devenu rapidement un produit industriel important. Il est le chef de file de toute une série d'acides aminopolycarboxyliques qui ont des propriétés voisines quant à la chélation des cations métalliques.
Le nombre de maillons d'un cycle de chélation dépend évidemment de la nature du coordinat ; comme on pouvait s'y attendre, ce sont, comme pour les composés organiques, les cycles à cinq ou six maillons qui présentent le maximum de stabilité. Précisons cependant que les chélates les plus stables comportent des cycles à cinq maillons pour les coordinats saturés et à six maillons pour les coordinats non saturés.
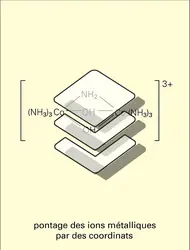
Complexes polynucléaires
Ces composés peuvent contenir deux ou plusieurs ions centraux (p > 1 dans MpHqArBs) comme Co2 (CO)8, Mn2(CO)10. Il peut y avoir une ou des liaison(s) métal-métal ou un pontage des ions métalliques par les coordinats comme dans l'ion hexaamino-μ-amido-μ-dihydroxodicobalt (III). Un cas très intéressant concerne les clusters, qui sont des molécules[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- René-Antoine PARIS : Professeur honoraire à l'Université Claude Bernard de Lyon-I
- Jean-Pierre SCHARFF : docteur ès sciences physiques, professeur des Universités
Classification
Médias
Autres références
-
ACIDES & BASES
- Écrit par Yves GAUTIER et Pierre SOUCHAY
- 12 364 mots
- 7 médias
Considérons les complexes d'un ion métallique M2+ accepteur, avec un donneur X— (ions Cl—, SCN—, par exemple).
-
ANALYTIQUE CHIMIE
- Écrit par Alain BERTHOD et Jérôme RANDON
- 8 885 mots
- 4 médias
...plusieurs doublets électroniques capables de former une ou plusieurs liaisons covalentes avec l'ion. Le produit formé (composé de coordination) est appelé complexe. Par exemple, la glycine est un acide aminé capable de former un complexe avec l'ion cuivre Cu2+, le glycinate de cuivre Cu(NH2CH2COO)2... -
ARGENT, métal
- Écrit par Robert COLLONGUES
- 5 165 mots
- 6 médias
-
BORE
- Écrit par Jean CUEILLERON
- 5 304 mots
- 6 médias
Avec les corps polyhydroxylés (glycérine, acides-alcools, acides-phénols...) l'acide borique donne de nombreux complexes. En particulier, la glycérine et surtout le mannitol conduisent à la formation de complexes d'addition qui sont des acides beaucoup plus forts que l'acide borique pur ; avec cet... - Afficher les 27 références