CONFORMATIONS, chimie
Article modifié le
Conformations des composés cycliques
La non-planéité de la plupart des systèmes hydrocarbonés cycliques non aromatiques est maintenant un fait bien établi. Dès 1890, en effet, Sachse proposait, pour le cyclohexane, l'existence de deux formes « plissées », dans lesquelles les angles valenciels conservaient leur valeur usuelle de 1090 27′. Cette hypothèse hardie, pleinement démontrée par la suite, limitait l'importance de la théorie des tensions de Baeyer (1885) basée sur le concept de cycles plans avec des angles valenciels plus grands que 1090 (pour les cycles de plus de 5 carbones), ou plus petits (pour les cycles de moins de 5 carbones).
Systèmes monocycliques saturés
Cyclohexane
Les systèmes cyclohexaniques sont de très loin les plus importants : un grand nombre de produits naturels (stéroïdes, terpénoïdes, alcaloïdes) contiennent, dans leur molécule, au moins un noyau à six atomes de carbone. C'est Sachse qui, le premier, a supposé l'existence d'un cycle non plan pour le cyclohexane : la molécule peut prendre deux formes spatiales différentes qui respectent les angles valenciels et les longueurs des liaisons : (14) est appelée conformation (ou forme) chaise, (15) est appelée conformation (ou forme) bateau. (14) et (15) sont bien deux conformations d'une même molécule : on peut passer de l'une à l'autre par le jeu des libres rotations, sans rompre aucune liaison.
Sous la forme chaise (14), on peut constater qu'il existe deux positions nettement différentes pour les hydrogènes ; six (un pour chaque carbone) sont en gros dans le plan moyen du cycle : on les appelle équatoriaux. Les six autres sont perpendiculaires au même plan moyen (trois de chaque côté) et sont appelés axiaux.
Les projections de Newmann de ces deux conformations chaise (14) et bateau (15) mettent en évidence le fait que la forme chaise est formée uniquement de structures « butane » décalées, alors que la forme bateau comprend deux structures « butane » éclipsées. On peut, par conséquent, en déduire que la conformation chaise sera très privilégiée : à température ordinaire et en phase condensée, le cyclohexane existe pour plus de 98 p. 100 sous sa forme chaise. En terme d'énergie, (14) est « plus stable » que (15) de 28,8 kJ/mole.
Cyclohexanes substitués
Un composé cyclohexanique monosubstitué peut exister sous deux conformations chaise : dans l'une, (16), le substituant R occupe une position axiale, dans l'autre, (17), une position équatoriale. Ces deux conformations (16) et (17) sont interconvertibles (E. Mohr, 1918), les formes bateau peu probables, analogues à (15), n'étant d'ailleurs que les intermédiaires de cette transformation appelée version (tabl. 1).
Dans ce qui va suivre, on considérera comme négligeable la participation de ces formes bateau et on n'étudiera que l'équilibre (17) ⇌ (16), qui, dans la plupart des cas, sera seul représentatif d'un cyclohexane monosubstitué.
Les projections, tant de Newmann que perspectives, des conformations (16) et (17) font apparaître un nouveau type d'interaction dite interaction-1,3 diaxiale : dans (16), en effet, il existe une certaine répulsion entre le groupement R axial et les deux hydrogènes, eux aussi axiaux, portés par les carbones 3 et 5. Ces positions axiales de deux carbones β sur un cyclohexane chaise sont, en effet, plus proches dans ce cas que les deux positions équatoriales de deux carbones voisins. Il s'ensuit que (16) va avoir une énergie plus forte que (17), qui, par conséquent, sera toujours la conformation privilégiée. La position de l'équilibre (17) ⇌ (16) dépend de la nature de R : le tableau 2 donne quelques valeurs des différences d'énergie libre (ΔG0R) des deux conformations pour des substituants divers. On peut constater que cette différence d'énergie est plus faible lorsque R est un halogène : la position axiale est alors moins défavorisée, car la longueur plus grande de la liaison C—X par rapport à la liaison C—C entraîne l'existence d'une plus grande distance entre l'halogène et les hydrogènes axiaux en β, donc une diminution de l'interaction-1,3 diaxiale. Dans le cas des chloro- ou bromo-cyclohexanes, la participation de (16) à l'équilibre sera importante. Par contre, pour les alcoyl-cyclohexanes, la conformation (17) est toujours très favorisée (au moins 80 p. 100). Elle devient pratiquement seule présente lorsque R est un groupe t-butyle : un des méthyles de ce groupe se trouve alors très près des hydrogènes axiaux des carbones β, ce qui entraîne une forte valeur de l'énergie de cette conformation à t-butyle axial. Pour cette raison, un cyclohexane portant un groupement t-butyle est considéré comme ayant une structure rigide avec ce substituant équatorial et peut être à ce titre employé comme modèle dans de nombreuses études stéréochimiques.
L' analyse conformationnelle des dérivés disubstitués du cyclohexane devient d'autant plus compliquée que le nombre de possibilités est plus grand. On peut en général extrapoler les résultats obtenus avec les cyclohexanes monosubstitués : la conformation privilégiée sera celle qui réunira le maximum de substituants en position équatoriale ; les chiffres de la table ci-dessus pourront alors servir de guide, Δ G0R mesurant en fait « l'affinité » de tel ou tel substiuant pour la position équatoriale. Par exemple, dans le cas du trans-méthyl-4-chlorocyclohexane (18), la conformation exclusivement présente sera (18 e), dans laquelle les deux groupements sont équatoriaux. Dans le cas de l'isomère cis (19), par contre, les deux conformations (19 a) et (19 b) seront possibles, mais (19 a) sera privilégiée car l'énergie de la molécule sera moindre avec un chlore axial qu'avec un méthyle dans la même position.
Autres cycles
Comme le cyclohexane, les cycles contenant plus de 6 atomes de carbone ont une structure non plane conservant à l'angle valenciel sa valeur de 1090 27′. Certaines conformations limites sont là aussi possibles et, suivant la substitution du système, elles seront susceptibles d'exister simultanément ; alors la structure réelle de la molécule pourra être décrite en terme d'équilibre conformationnel entre ces diverses formes.
Les conformations privilégiées, analogues à la forme chaise, de quelques hydrocarbures à cycle moyen sont représentées dans le tableau 3.
Du fait de leur plus grand nombre de carbones, ces cyclanes sont plus flexibles que le cyclohexane et, généralement, le nombre de conformations stables est supérieur à deux. Pour le cycloheptane, il existe à côté des formes chaise et bateau, voisines de celles du cyclohexane, une forme croisée, dont la basse énergie fera, dans certains cas, la conformation privilégiée. Il est à noter qu'une forme analogue est quelquefois prise en considération pour le cyclohexane, mais son énergie est notablement plus forte que celle de la forme chaise.
On sait aussi que le cyclopentane et le cyclobutane ne sont pas plans. Le premier existe sous deux conformations d'énergie voisine : (20), appelée demi-chaise, et (21) appelée enveloppe ; et le cyclobutane a une structure plissée (22), dont l'angle est d'environ 200.
Dans ces deux cas, une forme plane du cycle entraînerait l'éclipse de tous les hydrogènes, ce qui conférerait à la molécule une forte énergie. Celle-ci est, en effet, moindre sous les formes (20), (21) et (22), dans lesquelles les hydrogènes sont en position gauche.
Systèmes polycycliques saturés
Les systèmes polycycliques naturels contiennent souvent uniquement des noyaux cyclohexane et cyclopentane. Les conformations de plus grande stabilité sont toujours celles où la majorité des cycles peut adopter une conformation chaise. C'est le cas de la trans-décaline (23) et aussi des stéroïdes à jonctions normales (toutes trans) comme le cholestane (24).
La cis décaline (25) peut exister sous deux conformations : (25 a), dite de « type stéroïde », et (25 b), dite de « type non stéroïde ». Ces noms proviennent du fait qu'un stéroïde de jonction A/B cis comme le coprostane (26) ne peut avoir, à cause de l'existence du cycle C, qu'une seule conformation analogue à (25 a).
Cyclohexanones
Les règles vues à propos des cyclohexanes substitués s'appliquent normalement aux cyclohexanones : la conformation privilégiée d'une telle cétone sera généralement la forme chaise ayant le maximum de substituants en position équatoriale.
Deux faits sont toutefois à signaler :
– Lorsqu'une cyclohexanone est substituée en α du carbonyle par un groupement alcoyle, il existe une interaction entre celui-ci en position équatoriale et le carbonyle. La conformation à substituant équatorial est alors légèrement déstabilisée : la méthyl-2-cyclohexanone (27) existe pour 15 p. 100 environ sous une conformation (27 a) à méthyle axial. De même, l'isomenthone (28) a pour conformation privilégiée (28 a) à isopropyle axial. Ce phénomène est connu sous le nom d'effet alcoyl-2-cétone.
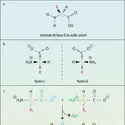
– Lorsqu'une cyclohexanone est bromée en α, il existe une interaction dipôle-dipôle entre le carbonyle Cδ+ ....— Oδ–et la liaison Cδ+ — Brδ–, qui entraîne de grosses différences de polarité entre les deux conformations axiale et équatoriale de l'atome de brome. La forme la plus polaire qui est celle où les deux dipôles sont parallèles (recouvrement maximal des orbitales) est favorisée dans les solvants polaires : dans l'éthanol, la bromo-2-cyclohexanone existe de préférence sous sa conformation à brome équatorial. Au contraire, la forme la moins polaire à brome axial est nettement favorisée dans les solvants apolaires comme les hydrocarbures.
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques GORÉ : Professeur à l'université Claude Bernard, Lyon.
Classification
Médias
Autres références
-
ALCANES
- Écrit par Jacques METZGER
- 3 616 mots
- 11 médias
...étant formée d'atomes de carbone tétracoordinés (hybridation sp3), l'angle que font entre elles les liaisons σ qui en sont issues est voisin de 1100. Les interactions (répulsives) entre atomes non liés portés par deux carbones voisins varient avec leurs positions relatives, c'est-à-dire avec la ... -
AMINOACIDES ou ACIDES AMINÉS
- Écrit par Encyclopædia Universalis et Pierre KAMOUN
- 3 487 mots
- 6 médias
Dans un polypeptide et une protéine, il peut s'établir des liaisons très nombreuses non covalentes, de faible énergie, entre les liaisons peptidiques elles-mêmes et entre les radicaux, qui donnent au polypeptide leur conformation dans l’espace. -
ANFINSEN CHRISTIAN BOEHMER (1916-1995)
- Écrit par Georges BRAM et Encyclopædia Universalis
- 468 mots
Christian Anfinsen était un biochimiste américain connu pour ses travaux sur la structure des protéines et particulièrement sur la relation entre la séquence en acides aminés de l’enzyme ribonucléase et la conformation dans l’espace de l’enzyme active. Il a partagé le prix Nobel de chimie en 1972...
-
ANTIGÈNES
- Écrit par Joseph ALOUF
- 7 384 mots
- 5 médias
...dans deux segments peptidiques très éloignés l'un de l'autre dans la chaîne polypeptidique constitués par les résidus aminoacides 18 à 27 et 117 à 128, mais très proches dans la configuration native de l'antigène en raison du repliement de la chaîne dans la structure tridimensionnelle de la molécule protéique.... - Afficher les 30 références
Voir aussi
- CIS CONFIGURATION
- TRANS CONFIGURATION
- SUBSTITUANT, chimie
- ANALYSE CONFORMATIONNELLE
- ÉQUILIBRE, chimie
- CYCLIQUES COMPOSÉS
- ÉTHANE
- BUTANE
- SIMPLE LIAISON
- GAUCHE CONFORMATION
- HALOGÉNÉS DÉRIVÉS
- LIBRE ROTATION, chimie
- NEWMAN PROJECTION DE
- CHAISE CONFORMATION
- BATEAU CONFORMATION
- ÉQUATORIALE LIAISON
- AXIALE LIAISON
- CROISÉE CONFORMATION
- CYCLOHEXANONES
- CÉTONES
- ALIPHATIQUES ou ACYCLIQUES COMPOSÉS
- DÉCALÉE CONFORMATION
- ÉCLIPSÉE CONFORMATION
- ANTI CONFORMATION
- CYCLOBUTANE
- CYCLOPENTANE
- VERSION, chimie organique
- ÉNERGIE POTENTIELLE
- DÉCALINE