COORDINATION (chimie) Composés de coordination
Article modifié le
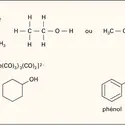
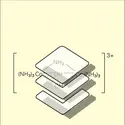
Un composé de coordination est une entité chimique constituée d'un atome central et d'un ou plusieurs coordinats, ou ligands, éventuellement en nombre supérieur à celui qui résulterait de la valence ou du degré d'oxydation usuel de l'atome central. Un certain nombre de ces composés avaient été décrits dès le milieu du xviiie siècle ; dans la seconde moitié du xixe siècle, divers chimistes, en particulier Blumstrand et S. M. Jorgensen, tentèrent d'appliquer à ce type de composés, appelés alors improprement « combinaisons moléculaires », les théories de la valence et de l'enchaînement des atomes (on dit maintenant « caténation ») qui venaient de faire preuve de leur bien-fondé dans le domaine de la chimie organique. L'idée de la coordination d'ions ou de groupes d'atomes suivant une disposition géométrique autour d'un ion central fut émise en 1893 par Alfred Werner, véritable fondateur de la chimie de coordination, qui reçut le prix Nobel en 1913. Werner montra, par exemple, que les propriétés des complexes ayant un nombre de coordination égal à 6 pouvaient s'interpréter en admettant que les six groupements fixés étaient disposés, autour de l'atome central, aux sommets d'un octaèdre régulier. Ainsi, la combinaison moléculaire CoI3,6NH3 devait en réalité se formuler [Co(NH3)6]I3. Une autre propriété importante que Werner put expliquer ainsi était l'existence des isomères cis-trans : plus tard, il dédoubla des racémiques dont il avait prévu l'existence.
En France, à partir de 1906, Delépine compléta l'œuvre de Werner, que les travaux de Miolati et Rosenheim étendirent aux cas des oxyanions polynucléaires dérivant des isopolyacides et des hétéropolyacides fréquemment rencontrés dans le cas du molybdène (VI) et du tungstène (VI) mais aussi à un degré moindre avec le vanadium (V), le niobium (V), le tantale (V) et l'uranium (VI). Jusqu'au milieu du xxe siècle, divers physico-chimistes tels que Jander, Keggin, Pauling, Souchay réussirent à adapter les conceptions de Werner à ces composés.
Par ailleurs, après les premières théories ioniques et électroniques de Kossel, Lewis, Langmuir, Sidgwick, il fallut attendre 1930-1940 pour que des concepts plus élaborés concernant la liaison de coordination apparaissent avec la théorie de l'hybridation des orbitales de Pauling, Prix Nobel de Chimie en 1954, et de Slater. Avec l'accumulation de données expérimentales ne corroborant pas cette théorie, notamment en ce qui concerne les propriétés magnétiques de nombreux complexes métalliques, il fallut avoir recours, vers 1950, sous l'impulsion de Balhausen, Cotton, Griffith, C. K. Jorgensen et Orgel, à la théorie du champ cristallin (en anglais crystal field theory, C.F.T.), ultérieurement étendue et généralisée par la théorie du champ de ligand (en anglais ligand field theory, L.F.T.).
Des milliers de complexes sont aujourd'hui connus, et un très grand nombre d'entre eux ont des applications pratiques décisives dans certains domaines tels que celui de la catalyse homogène. Il faut noter que les recherches relatives aux composés de coordination se sont constamment développées. C'est ainsi, que soixante-quatorze ans après Werner, ce sont trois chimistes ayant synthétisé de nouveaux ligands tels que les molécules creuses du type éther-couronne ou cryptate qui se voient attribuer le prix Nobel de chimie en 1987 : Cram, Lehn et Pedersen.
La coordinence
La plupart des complexes métalliques comprennent un atome métallique constituant l'atome central et des ions, des atomes ou des molécules coordinés. L'atome métallique central est généralement à l'état de cation avec un degré d'oxydation positif bien que l'on connaisse des complexes où le degré d'oxydation formel du métal est nul, comme dans Ni(CO)[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean AMIEL : ancien élève de l'École nationale supérieure de physique et de chimie de Paris, agrégé de physique, professeur honoraire de chimie générale à l'université de Paris-VI-Pierre-et-Marie-Curie
- Jean-Pierre SCHARFF : docteur ès sciences physiques, professeur des Universités
Classification
Médias
Autres références
-
ARGENT, métal
- Écrit par Robert COLLONGUES
- 5 167 mots
- 6 médias
L'argent se distingue très nettement de ses partenaires du groupe I b.En effet, les coordinations habituelles pour le cuivre et l'or sont 2 et 4, les plus importantes étant 4 pour le cuivre et 2 pour l'or. L'argent adopte indifféremment les coordinations 2, 4 et 6, et la coordination 3 peut aussi... -
CHIMIE - La chimie aujourd'hui
- Écrit par Pierre LASZLO
- 10 856 mots
- 3 médias
Lachimie de coordination étudie les complexes, où un atome de métal s'entoure de molécules neutres ou d'ions, désignés sous le nom de coordinats (ou ligandes ou ligands), qui sont des bases de Lewis, porteuses d'au moins une paire d'électrons. Les ions métalliques ont des orbitales vacantes, ce sont... -
CHIMIE - La nomenclature chimique
- Écrit par Nicole J. MOREAU
- 5 031 mots
- 7 médias
C'est un système additif, développé à l'origine pour lescomposés de coordination, qui sont des composés formés d'un ou plusieurs atomes centraux au(x)quel(s) sont attachés d'autres atomes ou groupes d'atomes, appelés ligands. Ces ligands définissent un polyèdre de coordination... -
COMPLEXES, chimie
- Écrit par René-Antoine PARIS et Jean-Pierre SCHARFF
- 4 306 mots
- 5 médias
...supérieur, résultant de l'association de coordinats en nombre supérieur à celui fixé par la valence normale de l'ion métallique. En effet, la théorie de la coordination fut proposée en 1893 par Alfred Werner (prix Nobel de chimie en 1913) dont les travaux permirent de développer rapidement l'aspect structural... - Afficher les 10 références
Voir aussi
- IONS
- COORDINENCE ou NOMBRE DE COORDINATION
- RÉACTIONNELS MÉCANISMES
- BASE, chimie
- COORDINATION LIAISON DE
- ORBITALES ATOMIQUES
- IONS MÉTALLIQUES
- OXYDORÉDUCTION
- SUBSTITUTION, chimie
- CYCLIQUES COMPOSÉS
- CHARGE ÉLECTRIQUE
- ANIONS
- CATIONS
- VITESSE DE RÉACTION
- COVALENTE LIAISON
- SLATER JOHN CLARKE (1900-1976)
- ORBITALES MOLÉCULAIRES
- HYBRIDATION DES ORBITALES
- LCAO (linear combinations of atomic orbitals)
- LIGAND ou COORDINAT, chimie
- HUND RÈGLE DE
- DEGRÉ D'OXYDATION
- NUCLÉOPHILES SUBSTITUTIONS
- LIAISONS DE VALENCE MÉTHODE DES
- OCTAÈDRE, stéréochimie
- CONFIGURATION ÉLECTRONIQUE
- CHÉLATION
- TRANSITION MÉTAUX DE
- STÉRÉO-ISOMÉRIE
- STABILITÉ, chimie
- CHIMIE HISTOIRE DE LA
- CHAMP CRISTALLIN THÉORIE DU
- RÉACTIVITÉ CHIMIQUE
- JAHN-TELLER EFFET
- IONIQUE RAYON
- IONIQUE LIAISON
- DONNEUR, chimie
- ACCEPTEUR, chimie
- CHAMP DE COORDINATS THÉORIE DU
- PEARSON RALPH GOTTFRIED (1919- )
- TRANSFERT D'ÉLECTRONS
- COORDINATION COMPOSÉS DE