COORDINATION (chimie) Composés de coordination
La liaison de coordinence
Théorie ionique
Introduite par Kossel, la théorie ionique ne sera pas développée ici, car il est évidemment peu réaliste de considérer que les interactions entre un cation métallique et des coordinats puissent être purement ioniques.
Théorie électronique
L'hypothèse de base proposée par Sidgwick consiste à considérer, dans le cas d'un complexe octaédrique, l'établissement de six liaisons datives entre le cation métallique central jouant le rôle d' accepteur d' électrons, c'est-à-dire d'acide de Lewis, et six doublets électroniques de ligand(s) jouant un rôle de donneur d'électrons, c'est-à-dire de base de Lewis. Les liaisons orientées dans l'espace permettent d'expliquer les stéréo-isoméries. Sidgwick a introduit la notion de nombre atomique effectif qui représente le nombre total des électrons entourant l'atome central compte tenu des doublets mis en commun ; si Z est le numéro atomique de l'atome central, V la valeur algébrique de la valence de l'ion correspondant, et C la coordinence, on a : Zeff = Z − V + 2C. Par exemple, pour le complexe Ni(CO)4 : Z = 28, V = 0, C = 4 et Zeff = 36 ; le nombre atomique effectif correspondant alors au numéro atomique du gaz rare situé à la fin de la période considérée, c'est-à-dire le krypton dans l'exemple choisi. Si l'on ne considère que les 10 électrons périphériques 3d et 4s du nickel (0), son environnement est alors un environnement à 18 électrons. On a souvent postulé que les complexes satisfaisant à cette règle dite du gaz rare, ou règle des 18 électrons, étaient dotés d'une stabilité particulière, et on a souvent utilisé cette règle pour déterminer les stœchiométries des composés de coordination. Là encore, les données récentes montrent que, si cette règle s'applique strictement dans le cas de ligands possédant des orbitales η telles que CO, CN-, etc., elle ne peut être appliquée dans le cas général des métaux de la première série de transition où l'environnement électronique peut varier de 12 à 22 (toujours dans le cas de complexes octaédriques) et qu'il existe de nombreuses exceptions pour les métaux des deuxième et troisième séries de transition où, cependant, l'environnement électronique ne dépasse jamais 18.
Théorie des liaisons de valence
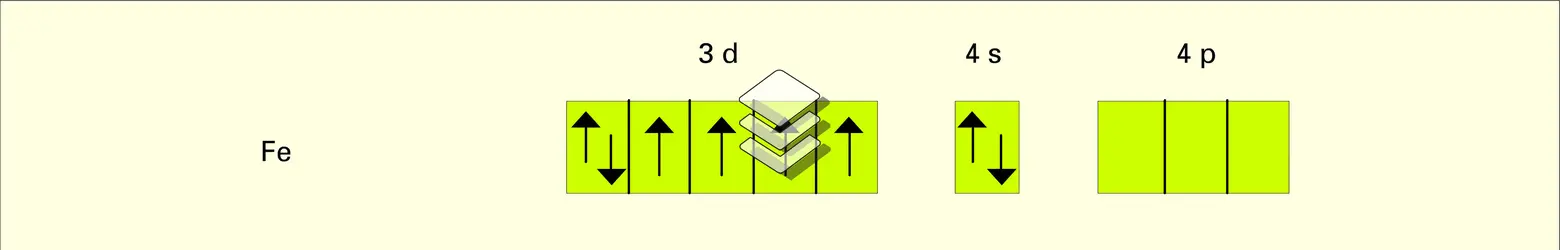
Dans le cas de la théorie des liaisons de valence, Pauling et Slater ont montré que, pour un complexe octaédrique, on pouvait faire appel à la notion d' hybridation de deux orbitales nd, d'une orbitale (n + 1)s et de trois orbitales (n + 1)p pour aboutir à la formation de six orbitales hybrides d2sp3 équivalentes occupées par les paires électroniques des coordinats. Un raisonnement analogue pourrait être effectué pour un complexe carré plan (hybridation dsp2) ou pour une symétrie tétraédrique (hybridation sp3).
La figure illustre cette démarche. On constate que, si l'ion Fe3 possède bien 5 électrons non appariés, l'ion complexe [Fe(CN)6]3- n'en possède plus qu'un puisque deux orbitales d sont occupées par les électrons des ligands. Le moment magnétique d'un complexe étant donné par la formule simplifiée μ = √ n(n + 2) M.B., où M.B. représente le magnéton de Bohr et n le nombre d'électrons « célibataires », cela signifie que tous les complexes d'un même cation métallique devraient posséder des propriétés magnétiques voisines, ce qui s'est avéré très rapidement faux puisque, par exemple, un complexe comme [CoF6]3- est paramagnétique, alors que [Co(NH3)6]3+ est diamagnétique. Seules les théories C.F.T. et L.F.T. peuvent expliquer les lacunes des théories précédentes.
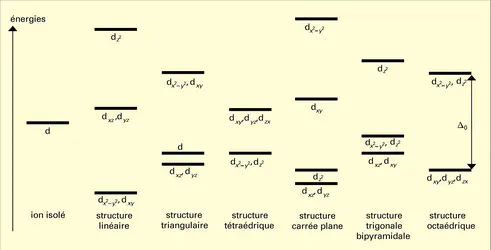
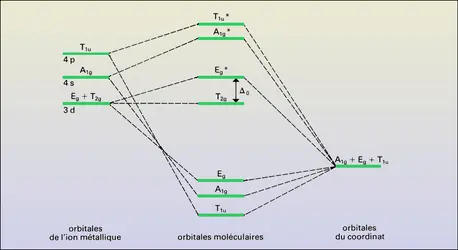
Théorie électrostatique du champ cristallin
Les cinq orbitales d des ions des métaux de transition[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean AMIEL : ancien élève de l'École nationale supérieure de physique et de chimie de Paris, agrégé de physique, professeur honoraire de chimie générale à l'université de Paris-VI-Pierre-et-Marie-Curie
- Jean-Pierre SCHARFF : docteur ès sciences physiques, professeur des Universités
Classification
Médias
Autres références
-
ARGENT, métal
- Écrit par Robert COLLONGUES
- 5 167 mots
- 6 médias
L'argent se distingue très nettement de ses partenaires du groupe I b.En effet, les coordinations habituelles pour le cuivre et l'or sont 2 et 4, les plus importantes étant 4 pour le cuivre et 2 pour l'or. L'argent adopte indifféremment les coordinations 2, 4 et 6, et la coordination 3 peut aussi... -
CHIMIE - La chimie aujourd'hui
- Écrit par Pierre LASZLO
- 10 856 mots
- 3 médias
Lachimie de coordination étudie les complexes, où un atome de métal s'entoure de molécules neutres ou d'ions, désignés sous le nom de coordinats (ou ligandes ou ligands), qui sont des bases de Lewis, porteuses d'au moins une paire d'électrons. Les ions métalliques ont des orbitales vacantes, ce sont... -
CHIMIE - La nomenclature chimique
- Écrit par Nicole J. MOREAU
- 5 031 mots
- 7 médias
C'est un système additif, développé à l'origine pour lescomposés de coordination, qui sont des composés formés d'un ou plusieurs atomes centraux au(x)quel(s) sont attachés d'autres atomes ou groupes d'atomes, appelés ligands. Ces ligands définissent un polyèdre de coordination... -
COMPLEXES, chimie
- Écrit par René-Antoine PARIS et Jean-Pierre SCHARFF
- 4 306 mots
- 5 médias
...supérieur, résultant de l'association de coordinats en nombre supérieur à celui fixé par la valence normale de l'ion métallique. En effet, la théorie de la coordination fut proposée en 1893 par Alfred Werner (prix Nobel de chimie en 1913) dont les travaux permirent de développer rapidement l'aspect structural... - Afficher les 10 références