COORDINATION (chimie) Composés de coordination
Article modifié le
Mécanismes de réactions
Du point de vue cinétique, les complexes inertes présentent des réactions suffisamment lentes pour être étudiées par les techniques conventionnelles. Par contre, pour les complexes labiles (temps de demi-réaction de 10-8 à une seconde), seul le développement de techniques spéciales, telles que les méthodes de compétition, de relaxation ou de perturbation spectroscopiques (R.M.N., R.P.E.) et électrochimiques, en a permis l'étude. Malgré tout l'intérêt présenté par ces techniques, nous nous limiterons aux principaux résultats concernant les mécanismes réactionnels de deux types de réactions importantes des complexes : substitutions et oxydo-réductions. Ces indications sont nécessairement qualitatives et sont simplement des exemples de la façon dont les chimistes tentent d'interpréter les données expérimentales.
Substitutions
Ces réactions sont des substitutions nucléophiles (SN) que l'étude cinétique permet de classer en deux groupes :
1. Les réactions SN1 du premier ordre à mécanisme dissociatif : les études des réactions de substitutions dans les complexes octaédriques d'un ion comme Co3+, par exemple, ont montré que l'étape importante (c'est-à-dire celle qui détermine la vitesse de la réaction) est celle qui implique la rupture de la liaison entre Co3+ et le groupe sortant. Le groupe entrant n'est pas impliqué dans cette étape initiale. La seconde étape, très rapide, est l'introduction du substituant. Exemple :
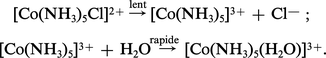
2. Les réactions SN2 du deuxième ordre (ou bimoléculaires) à mécanisme associatif.
Dans les complexes carrés plans, il est possible d'envisager un mécanisme comprenant d'abord le rattachement du groupe entrant avec formation d'un état de transition pentacoordiné. Exemple :
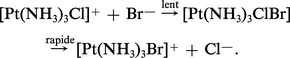
Ce mécanisme associatif (car l'étape déterminant la vitesse de substitution implique l'association du complexe et du groupe entrant) est confirmé par le fait que les vitesses de substitutions des complexes carrés plans dépendent fortement de la nature du groupe entrant (réaction du deuxième ordre).
Un processus analogue pour les complexes octaédriques implique la formation transitoire (plus difficile pour des raisons stériques) d'un complexe heptacoordiné.
Dans le cas des complexes octaédriques, pour une réaction SN2, si l'attaque se fait en position cis par rapport au coordinat qui est éliminé, il n'y a pas transposition ; mais cette dernière se produit si l'attaque se fait en position trans :
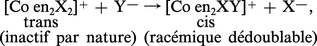
Réactions d'oxydo-réductions
Il existe deux types de transfert d'électrons. Le transfert électronique d'un complexe à un autre fait intervenir la formation transitoire d'un complexe activé ponté mis en évidence à l'aide d'isotopes radioactifs par Taube et ses collaborateurs. [Co(NH3)536Cl*]2+ par exemple est dissous dans une solution contenant Cr2+ et des ions Cl- non radioactifs ; après réduction, on obtient [Cr(H2O)536Cl*]2+ qui ne contient que du chlore radioactif. Le complexe activé qui permet le transfert d'électrons doit donc comporter un atome de chlore formant un pont permettant le transfert Cr2+ + Co3+ → Cr3+ + Cr2+. Dans un tel cas, non seulement des électrons, mais aussi des atomes ou des groupes d'atomes sont transférés. C'est le transfert atomique ou mécanisme à sphère interne.
Dans d'autres réactions rapides, on envisage un transfert direct entre les deux complexes. Il y a transfert d'électrons dans un complexe issu d'une collision mais sans substitution. Exemple :
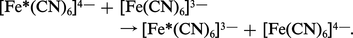
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean AMIEL : ancien élève de l'École nationale supérieure de physique et de chimie de Paris, agrégé de physique, professeur honoraire de chimie générale à l'université de Paris-VI-Pierre-et-Marie-Curie
- Jean-Pierre SCHARFF : docteur ès sciences physiques, professeur des Universités
Classification
Médias
Autres références
-
ARGENT, métal
- Écrit par Robert COLLONGUES
- 5 167 mots
- 6 médias
L'argent se distingue très nettement de ses partenaires du groupe I b.En effet, les coordinations habituelles pour le cuivre et l'or sont 2 et 4, les plus importantes étant 4 pour le cuivre et 2 pour l'or. L'argent adopte indifféremment les coordinations 2, 4 et 6, et la coordination 3 peut aussi... -
CHIMIE - La chimie aujourd'hui
- Écrit par Pierre LASZLO
- 10 856 mots
- 3 médias
Lachimie de coordination étudie les complexes, où un atome de métal s'entoure de molécules neutres ou d'ions, désignés sous le nom de coordinats (ou ligandes ou ligands), qui sont des bases de Lewis, porteuses d'au moins une paire d'électrons. Les ions métalliques ont des orbitales vacantes, ce sont... -
CHIMIE - La nomenclature chimique
- Écrit par Nicole J. MOREAU
- 5 031 mots
- 7 médias
C'est un système additif, développé à l'origine pour lescomposés de coordination, qui sont des composés formés d'un ou plusieurs atomes centraux au(x)quel(s) sont attachés d'autres atomes ou groupes d'atomes, appelés ligands. Ces ligands définissent un polyèdre de coordination... -
COMPLEXES, chimie
- Écrit par René-Antoine PARIS et Jean-Pierre SCHARFF
- 4 306 mots
- 5 médias
...supérieur, résultant de l'association de coordinats en nombre supérieur à celui fixé par la valence normale de l'ion métallique. En effet, la théorie de la coordination fut proposée en 1893 par Alfred Werner (prix Nobel de chimie en 1913) dont les travaux permirent de développer rapidement l'aspect structural... - Afficher les 10 références
Voir aussi
- IONS
- COORDINENCE ou NOMBRE DE COORDINATION
- RÉACTIONNELS MÉCANISMES
- BASE, chimie
- COORDINATION LIAISON DE
- ORBITALES ATOMIQUES
- IONS MÉTALLIQUES
- OXYDORÉDUCTION
- SUBSTITUTION, chimie
- CYCLIQUES COMPOSÉS
- CHARGE ÉLECTRIQUE
- ANIONS
- CATIONS
- VITESSE DE RÉACTION
- COVALENTE LIAISON
- SLATER JOHN CLARKE (1900-1976)
- ORBITALES MOLÉCULAIRES
- HYBRIDATION DES ORBITALES
- LCAO (linear combinations of atomic orbitals)
- LIGAND ou COORDINAT, chimie
- HUND RÈGLE DE
- DEGRÉ D'OXYDATION
- NUCLÉOPHILES SUBSTITUTIONS
- LIAISONS DE VALENCE MÉTHODE DES
- OCTAÈDRE, stéréochimie
- CONFIGURATION ÉLECTRONIQUE
- CHÉLATION
- TRANSITION MÉTAUX DE
- STÉRÉO-ISOMÉRIE
- STABILITÉ, chimie
- CHIMIE HISTOIRE DE LA
- CHAMP CRISTALLIN THÉORIE DU
- RÉACTIVITÉ CHIMIQUE
- JAHN-TELLER EFFET
- IONIQUE RAYON
- IONIQUE LIAISON
- DONNEUR, chimie
- ACCEPTEUR, chimie
- CHAMP DE COORDINATS THÉORIE DU
- PEARSON RALPH GOTTFRIED (1919- )
- TRANSFERT D'ÉLECTRONS
- COORDINATION COMPOSÉS DE