CRISTAUX
Article modifié le
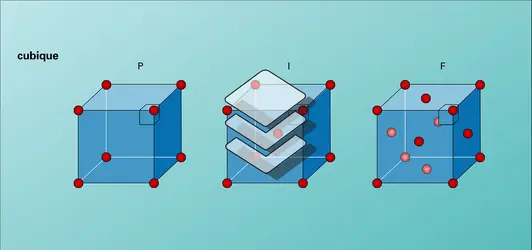
Les principales structures cristallines
La matière solide d'origine naturelle, aux propriétés chimiques pourtant très variées, apparaît presque toujours sous une forme cristalline à une échelle suffisamment petite. L'organisation cristalline est en effet souvent celle qui réduit au minimum l'énergie d'interaction entre les atomes d'un corps solide, d'où sa stabilité et sa pérennité. Selon les matériaux, les interactions entre les atomes sont de trois types : les liaisons métalliques (spécifiques des métaux purs et de leurs alliages), les liaisons ioniques (cas du sel de cuisine ou de la craie) et les liaisons covalentes (typiques du carbone et des matériaux semi-conducteurs).
Les structures métalliques
La cohésion des métaux est assurée par des liaisons fortes et sans orientation privilégiée entre les atomes. Dans un métal, les électrons périphériques des atomes sont complètement délocalisés et se trouvent partagés entre tous les atomes de la structure. Les structures métalliques sont caractérisées par une tendance à la compacité maximale. Dans le cas des métaux purs, constitués d'une seule sorte d'atome, les structures cristallines les plus compactes sont obtenues avec deux types de réseaux : le réseau cubique à faces centrées et le réseau hexagonal compact. Il existe un troisième type, le réseau cubique centré.
Le réseau cubique à faces centrées
Le modèle du réseau cubique à faces centrées (C.F.C.) est un empilement périodique de cubes identiques où les atomes occupent tous les sommets et tous les centres des faces des cubes. L'excellente compacité de ce réseau apparaît clairement lorsqu'on examine la répartition des atomes dans les plans perpendiculaires aux grandes diagonales des cubes. Dans de tels plans, les atomes forment en effet un réseau triangulaire où chaque atome est au contact des six atomes qui l'entourent en un hexagone parfait. C'est aussi la manière la plus compacte de ranger des verres sur une étagère ou des pommes sur un étal. Si nous imaginons qu'une première couche atomique a cette structure compacte très simple, nous devrons ensuite trouver un moyen d'empiler des couches identiques tout en optimisant la compacité de l'ensemble. On se représente facilement, par exemple en entassant des pommes, que les atomes de la deuxième couche vont naturellement se placer dans des creux de la première couche, c'est-à-dire au-dessus des centres des triangles. Dans ces conditions, il y a deux choix possibles pour positionner la deuxième couche. Un choix étant fait, il y a également deux choix possibles pour poser la troisième couche sur la deuxième : en se superposant exactement au-dessus de la première couche ou en positionnant les atomes au-dessus des creux de la première couche. C'est cette dernière possibilité qui caractérise le réseau C.F.C. Il y a finalement trois types de couches, A, B et C, qui se répètent périodiquement, de sorte que l'on a une succession de plans du type ABCABCABC... telle que la quatrième couche est à la verticale de la première, la cinquième à la verticale de la deuxième, et ainsi de suite. Dans ce type de réseau, chaque atome a douze voisins : six dans la même couche, trois immédiatement au-dessus et trois immédiatement en dessous. La compacité peut être caractérisée par le rapport entre le volume occupé par des sphères identiques situées sur ce réseau et le volume total (comprenant donc les vides entre sphères). On trouve alors un rapport voisin de 74 p. 100.
Les principaux métaux cristallisant dans ce réseau sont l'aluminium, le cuivre, le fer (dans la forme dite « gamma », encore appelée austénite) et le nickel.
Le réseau hexagonal compact
Le réseau hexagonal compact est très voisin du précédent en ce sens qu'il est formé de couches atomiques identiques. La seule différence[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Marc AUDIER : docteur, directeur de recherche au C.N.R.S.
- Michel DUNEAU : directeur de recherche au C.N.R.S.
Classification
Médias
Autres références
-
DÉTECTEURS DE PARTICULES
- Écrit par Pierre BAREYRE , Jean-Pierre BATON , Georges CHARPAK , Monique NEVEU et Bernard PIRE
- 10 981 mots
- 12 médias
Les scintillateurs inorganiques sont constitués de cristaux purs dopés par une impureté. Le plus important d'entre eux est l'iodure de sodium dopé avec du thallium dans la proportion de 1 p. 1 000 environ. -
AIGUE-MARINE
- Écrit par Yves GAUTIER
- 1 152 mots
- 1 média
-
ALLIAGES
- Écrit par Jean-Claude GACHON
- 7 363 mots
- 5 médias
...entre deux métaux, le zirconium (Zr) et le hafnium (Hf). Dans ce cas, on passe progressivement, dans l'état solide, de l'un à l'autre par remplacement, sur le réseau cristallin, des atomes du premier par ceux du second. Le produit est une solution solide qui ressemble au zirconium à gauche et au hafnium... -
ALMANDIN
- Écrit par Yves GAUTIER
- 330 mots
Nésosilicate de fer et d'aluminium, l'almandin est le grenat le plus commun. Il se présente sous forme de cristaux rhombododécaédriques, souvent centimétriques, de couleur rouge à rouge foncé avec des nuances violacées ou brunes.
Formule : Fe3Al2(SiO4)3 ; système : cubique ; dureté...
- Afficher les 114 références
Voir aussi
- MATÉRIAUX SCIENCE DES
- CRISTAL IONIQUE
- EMPILEMENT, cristallographie
- CRISTALLOGRAPHIE
- DIFFRACTION PAR LES CRISTAUX
- SYMÉTRIE, mathématiques
- COVALENTE LIAISON
- CHLORURE DE SODIUM
- CHLORURE DE CÉSIUM
- MÉTALLIQUE LIAISON
- CRISTALLOCHIMIE
- BRAGG LOI DE
- DÉFAUTS, cristallographie
- CRISTAL TOURNANT MÉTHODE DU
- POLYMORPHISME, physique du solide
- SMECTIQUE ÉTAT
- RÉSEAU, cristallographie
- ORTHORHOMBIQUE SYSTÈME ou SYSTÈME TERBINAIRE, cristallographie
- TRICLINIQUE SYSTÈME, cristallographie
- LAUE MÉTHODE DE
- NÉMATIQUE ÉTAT
- FACES CENTRÉES RÉSEAUX À
- NŒUD, cristallographie
- MAILLE, cristallographie
- MILLER INDICES DE
- CHOLESTÉRIQUE ÉTAT
- GROUPES D'ESPACE ou GROUPES DE SCHÖNFLIES-FEDOROV
- CUBIQUE SYSTÈME, cristallographie
- BRAVAIS RÉSEAUX DE
- TEMPÉRATURE
- SOLIDES PHYSIQUE DES
- TÉTRAÈDRE, stéréochimie
- ALLOTROPIE
- MATIÈRE CONDENSÉE PHYSIQUE DE LA
- MICROSCOPIE ÉLECTRONIQUE À TRANSMISSION
- PLAN RÉTICULAIRE
- SOLIDE ÉTAT
- IONIQUE LIAISON
- BRAVAIS AUGUSTE (1811-1863)
- SYSTÈMES CRISTALLINS
- GROUPES PONCTUELS
- FACES, cristallographie
- MODÉLISATION
- TRANSLATION, mathématiques
- ROTATION, mathématiques
- STRUCTURE CRISTALLINE
- DENSITÉ ÉLECTRONIQUE
- DIFFRACTION NEUTRONIQUE
- QUASI-PÉRIODICITÉ
- SYMÉTRIE NON CRISTALLINE
- CUBIQUE À FACES CENTRÉES (CFC) RÉSEAU
- CUBIQUE CENTRÉ (CC) RÉSEAU
- HEXAGONAL COMPACT (HC) RÉSEAU
- PHYSIQUE HISTOIRE DE LA
- SCIENCES HISTOIRE DES