CROISSANCE, biologie
Article modifié le
Croissance humaine
La croissance staturale humaine résulte avant tout du développement du squelette jusqu'à l'âge adulte. Elle dépend donc essentiellement de l'activité des cartilages de conjugaison, constitués de cellules en constant renouvellement, qui préparent à leur contact la formation de tissu osseux permettant l'allongement des pièces squelettiques. La disparition de ces cartilages remplacés par du tissu osseux définitif marque la fin de la croissance. Il apparaît ainsi que la croissance du squelette va dépendre de trois grands facteurs : l'intégrité des cartilages intervenant dans l'ossification enchondrale (au niveau des os longs et des vertèbres), la présence des hormones et des facteurs de croissance cellulaire qui règlent cette activité, enfin un état nutritionnel satisfaisant permettant une réponse cellulaire normale aux hormones. Les défaillances de l'un ou l'autre de ces facteurs engendrent des situations cliniques, c'est-à-dire des maladies, bien identifiées, éventuellement susceptibles d'être traitées, après analyse de leurs causes.
La diversité de la structure des segments osseux joue un grand rôle. Elle explique que l'effet des hormones soit différent selon l'âge. Ainsi le développement rapide de la face et des os du crâne chez le nourrisson est principalement sous la dépendance des hormones thyroïdiennes et de l'hormone de croissance. Au moment de la puberté, les hormones sexuelles, chez le garçon et chez la fille, contribuent à modifier les rapports de longueur entre le tronc (ou segment supérieur) et les membres inférieurs (ou segment inférieur). Il est bien connu qu'en l'absence de puberté se constitue un aspect eunuchoïde dû à l'allongement relativement plus grand des membres inférieurs dont la croissance se prolonge au-delà de l'âge normal. En effet, lors de la puberté, les hormones sexuelles provoquent une accélération de croissance qui comporte deux composantes : l'une initiale au niveau des membres inférieurs (os longs), l'autre plus prolongée au niveau du tronc. Un autre exemple de l'effet des hormones sexuelles est représenté par l'apparition brusque des scolioses vertébrales lorsque commence la puberté. Une croissance normale implique donc l'intégrité du squelette, et en particulier celle du cartilage de croissance. On comprend ainsi que toute anomalie constitutionnelle ou génétique du cartilage de croissance ou de la formation du tissu osseux (maladies héréditaires du squelette) conduise à une situation de résistance aux hormones avec retard de croissance souvent sévère et variable selon la localisation des cartilages lésés.
Le système hormonal agit par voie endocrine : il transmet à l'ensemble de l'organisme par voie sanguine les signaux chimiques que constituent les hormones. Chaque hormone agissant sur les segments du squelette qui lui sont le plus sensibles, et ce en fonction de l'âge de l'enfant, l'ossification des divers segments osseux progresse à des vitesses variables. D'autres travaux ont montré qu'il existait aussi un second système situé au niveau des cellules constituant les tissus cibles. Ainsi, dans un organe donné, on parlera de signaux locaux agissant de cellule à cellule (système paracrine) ou au niveau d'une seule cellule (système autocrine). Ces signaux peuvent être déclenchés par des facteurs de croissance cellulaire provenant de la circulation générale ou plus probablement produits localement. Au niveau du squelette, on connaît les somatomédines (ou IGF, cf. infra) et d'autres peptides appartenant à la famille du FGF (fibroblast growth factor). Ces mécanismes locaux complètent le système endocrine et assurent souvent la réponse tissulaire aux hormones en conférant à chaque organe sa spécificité.
Nutrition et hormones sont étroitement liées. Il est démontré que la croissance dépend fortement de l'état de nutrition de l'individu. On peut schématiquement considérer que l'un des premiers effets de la dénutrition est la réduction des synthèses protéiques et en particulier de celles qui permettent la production de facteurs de croissance cellulaire et la réponse à l'hormone de croissance.
Système endocrinien et croissance
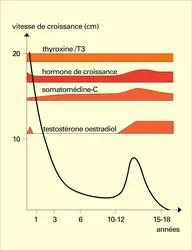
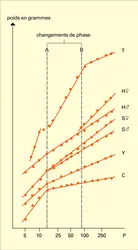
L' ensemble du système endocrinien qui va contrôler la croissance jusqu'à l'âge adulte est en place dès la naissance. Comme le montre la figure 6, on peut retenir un schéma général reliant la production des diverses hormones et les variations de la vitesse de croissance selon l'âge.
La cinétique de la croissance peut s'analyser comme la superposition de trois phénomènes, dont deux sont hormono-dépendants.
– Il existe une croissance basale qui reflète le seul potentiel de multiplication cellulaire du squelette, et qui fait suite à la période de croissance rapide du fœtus. Elle va diminuer lentement jusqu'à l'âge adulte et cesser lorsque les cartilages de conjugaison disparaissent.
– Cette croissance est stimulée par la présence de l'hormone de croissance, des somatomédines et des hormones thyroïdiennes. Sous l'effet combiné de ces hormones, le profil de croissance normale est réalisé, à l'exception du phénomène pubertaire qui relève d'une intervention hormonale supplémentaire. D'ailleurs, en l'absence de puberté (par absence de testicule ou d'ovaire), la croissance se prolonge jusqu'à un âge plus avancé que l'âge normal de fin de croissance sans pour autant conduire à une taille adulte nettement plus grande.
– Les hormones sexuelles sont en effet responsables d'une seconde modification qui survient à l'âge de la puberté : elles provoquent une accélération temporaire de la croissance et avancent ainsi le moment de la fermeture des cartilages de croissance. Cette forte croissance (20 p. 100 de la taille définitive est acquise au cours de la puberté) survient plus tôt chez la fille que chez le garçon.
L'hormone de croissance
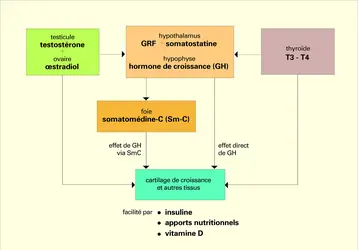
L' hormone de croissance (GH, ou growth hormone) est sécrétée par le lobe antérieur de l' hypophyse. La principale forme produite comporte 191 acides aminés et sa synthèse en laboratoire est maintenant possible grâce aux techniques de génie génétique. Elle est utilisée pour le traitement des enfants déficients en hormone de croissance. La sécrétion hypophysaire est contrôlée par deux facteurs hypothalamiques d'action opposée. Le GRF isolé par R. Guillemin (facteur de libération de la GH, ou GHreleasing factor) la stimule, alors que la somatostatine a une action inhibitrice. Il en résulte une modulation rythmée de cette sécrétion au long du nycthémère. Pendant le sommeil nocturne, la GH est sécrétée en beaucoup plus grande quantité. Il est probable que cette pulsatilité sécrétoire, sous l'influence des centres nerveux cérébraux, joue un rôle physiologique pour permettre une réponse cellulaire satisfaisante.
L'action de l'hormone de croissance sur le squelette se situe paradoxalement plus au niveau du foie qu'à celui du cartilage. En effet, elle dépend de la production par le foie, et probablement par d'autres cellules de l'organisme, d'un facteur de croissance appelé somatomédine. Celui-ci est un puissant stimulant de l'activité des cartilages, donc de la croissance.
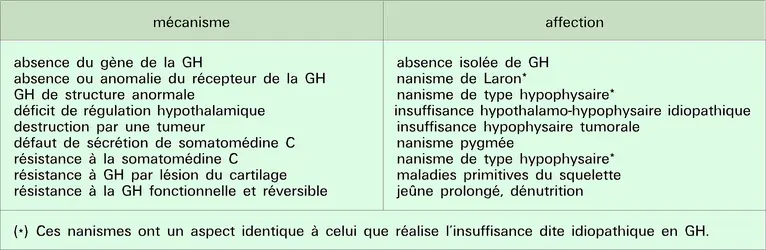
Bien des indices tendent à suggérer une plus grande complexité des phénomènes, car l'hormone de croissance pourrait aussi agir directement sur certaines cellules du cartilage de croissance pour initier leur développement en cellules plus matures, et préparer ainsi le cartilage à une meilleure réponse à la somatomédine. Pour stimuler la croissance staturale, l'hormone de croissance agit donc à deux niveaux. Elle assure d'une part la production d'un facteur de croissance par le foie et, d'autre part, elle provoque la différenciation de certaines cellules cartilagineuses pour les rendre sensibles à ce facteur de croissance et capables de le produire elles-mêmes. Ces effets dépendent de la liaison de l'hormone de croissance à ses récepteurs spécifiques situés sur les membranes cellulaires des tissus cibles. Une absence ou une anomalie de structure de ce récepteur peut aussi empêcher la croissance, ce qui est d'ailleurs sans doute la cause d'un nanisme génétique très rare, dit nanisme de Laron. Il est aussi intéressant de noter qu'une situation comme le jeûne prolongé ou la malnutrition chronique provoque d'abord un changement au niveau du récepteur, rendant inactive l'hormone de croissance qui continue d'être produite dans ces cas-là. On peut alors parler de résistance fonctionnelle à l'hormone de croissance (tabl. 1).
La somatomédine C
La somatomédine C (médiateur de l'effet somatotrope de l'hormone de croissance) appelée aussi IGF 1 (insulin-like growth factor 1) fait partie d'une famille de peptides qui ont une communauté de structure et d'action avec l'insuline. Elle est codée par un gène distinct de celui de l'insuline. Elle possède ses propres récepteurs mais elle peut se lier aux récepteurs cellulaires de l'insuline. Ainsi s'explique la double action de la somatomédine C avec d'une part un effet hypoglycémiant et, d'autre part, une stimulation de la multiplication cellulaire et surtout des synthèses spécifiques. La croissance du squelette nécessite donc la présence de somatomédine C, que celle-ci soit apportée par voie sanguine en provenance du foie ou qu'elle soit produite localement par des cellules appartenant au cartilage de croissance lui-même. On a démontré, encore en utilisant de la somatomédine C de synthèse, que ce peptide pouvait à lui seul reproduire l'essentiel de l'effet somatotrope lorsqu'il est injecté à l'animal hypophysectomisé. Mais on ne sait pas encore si ces propriétés permettront une application thérapeutique chez l'enfant en croissance.
L'insuline
Cette hormone sécrétée par le pancréas a pour rôle principal de maintenir la glycémie à son niveau normal. Elle a aussi été longtemps considérée comme le principal facteur contrôlant la croissance cellulaire. On sait maintenant que ce rôle est en fait surtout assuré par la somatomédine C. Par contre, l'insuline est nécessaire au maintien de l'activité métabolique et énergétique de l'organisme sans laquelle aucune hormone ne peut agir normalement. Ainsi le retard de croissance survenant chez l'enfant diabétique mal traité relève de ce mécanisme. La correction parfaite du diabète par l'insulinothérapie permet la normalisation de la croissance staturale.
Les hormones thyroïdiennes
Dès la naissance, les hormones thyroïdiennes ( thyroxine ou T4 et plus probablement triiodothyronine ou T3) contrôlent la croissance. Leur absence empêche la mise en place d'une organisation normale du cartilage de croissance et s'accompagne d'une diminution de sécrétion de l'hormone de croissance. Une telle situation est provoquée par l'absence congénitale de glande thyroïde ou par l'insuffisance thyroïdienne tardive. Ces hormones contrôlent la formation de l'os, et leur diminution se traduit aussi par un retard très sévère de la maturation squelettique, donc de l'âge osseux. À l'inverse, l'hyperthyroïdie, qui est rare chez l'enfant, accélère la croissance staturale et la maturation de l'os. Il est intéressant de noter que, malgré leur habituelle intensité, les troubles de croissance dus à l'insuffisance thyroïdienne se réparent complètement grâce au traitement thyroïdien.
Les hormones glucocorticoïdes
Le cortisol, principale hormone sécrétée par la glande corticosurrénale, n'est pas nécessaire à la croissance squelettique. Par contre, une hypersécrétion de cortisol (maladie de Cushing) ralentit fortement la croissance. Cette situation est reproduite par l'administration continue et prolongée de corticoïdes de synthèse aux doses pharmacologiques utilisées dans divers traitements (maladies inflammatoires, syndrome de rejet après greffe d'organe). Ces corticoïdes agissent selon plusieurs mécanismes : diminution de la réponse du cartilage aux hormones et diminution de la sécrétion de GH par l'hypophyse.
La vitamine D et l'hormone parathyroïdienne
La vitamine D, en grande partie apportée par l'alimentation, est transformée en ses dérivés actifs, essentiellement au niveau du foie et du rein. Son absence chez le nourrisson provoque des lésions des cartilages de croissance, donc le ralentissement de celle-ci. Cet effet de la carence en vitamine D est d'autant plus net que l'enfant a normalement une croissance très rapide à cet âge. Il est en effet établi que la formation de l'os nécessite la présence de vitamine D et un équilibre phosphocalcique normal. Quant à la parathormone, sécrétée par les glandes parathyroïdes, on ne lui connaît pas un rôle important dans la croissance de l'enfant, alors qu'elle est nécessaire au remodelage et au renouvellement permanent du tissu osseux.
Les hormones sexuelles et la puberté
Sous l'effet des hormones sexuelles, la croissance est profondément modifiée au cours de la puberté chez le garçon et chez la fille.
L' estradiol sécrété par l'ovaire chez la fille et la testostérone provenant du testicule chez le garçon agissent essentiellement par leur effet stimulant sur la sécrétion hypophysaire d'hormone de croissance. Il en résulte une forte augmentation de la somatomédine C circulante, qui joue certainement un rôle dans la survenue de la poussée de croissance pubertaire. Il est probable que ces hormones sexuelles agissent aussi directement au niveau du tissu cartilagineux et de l'os dont ils stimulent l'activité.
Cet effet des hormones sexuelles au cours de la puberté a deux composantes : la stimulation de la croissance en longueur de l'os et la maturation squelettique épiphysaire qui conduit à la disparition du cartilage de croissance. Il en résulte d'abord une accélération de croissance qui passe par un maximum, environ deux à trois ans après le début de la puberté, et une évolution rapide de la maturation épiphysaire qui conduit à la disparition des cartilages de croissance. Cette évolution suit la progression normale de l'activité gonadique. Ainsi, chez la fille, les faibles concentrations d'estradiol observées au début de la puberté stimulent la croissance sans trop accélérer la maturation osseuse, puis, la concentration d'estradiol augmentant, survient la fermeture des cartilages de croissance. Cet effet en deux phases est probablement aussi applicable à la testostérone chez le garçon.
La croissance pubertaire chez le garçon commence à 11 ans et demi (valeur moyenne), devient maximale à 14 ans pour s'achever vers 17 ans. Cette séquence commence environ un an après l'apparition de la pilosité sexuelle. Chez la fille, l'accélération de croissance survient plus tôt car elle coïncide avec l'apparition des seins (vers 10 ans), pour être maximale à 12 ans. Au moment des premières règles, la croissance est déjà en phase de ralentissement. Après celles-ci, le gain statural est cependant encore notable (de 3 à 12 cm). Au début de la puberté, les filles ont atteint 82 p. 100 et les garçons 78 p. 100 de leur taille définitive.
Troubles de la croissance
On distinguera le cas de la croissance staturale et celui, plus particulier, de la croissance pubertaire en l'absence de troubles nutritionnels (tabl. 2), puis le cas particulier où ceux-ci existent.
Anomalies de la croissance staturale
La petite taille d'un enfant est le plus souvent constitutionnelle, isolée ou familiale. Elle peut aussi être due à un retard de croissance déjà commencé durant la grossesse ou retard de croissance à début intra-utérin. Dans ce cas, aucun traitement, en particulier hormonal, n'a fait la preuve de son efficacité en améliorant la taille adulte de ces enfants. Il faudra attendre encore plusieurs années pour savoir si un tel résultat peut être obtenu avec les préparations actuelles d'hormone de croissance humaine qui sont à l'étude.
En effet, le retard de croissance est rarement dû à une cause hormonale. Si celle-ci est diagnostiquée, des traitements efficaces peuvent être mis en œuvre : hormone de croissance humaine dans l'insuffisance hypophysaire ; bloquants de la puberté tels que les analogues du LHRH hypothalamique dans la puberté précoce ; thyroxine chez l'enfant en insuffisance thyroïdienne ; insuline chez l'enfant diabétique, pour ne citer que les principaux.
Les traitements ont pour but de restaurer une situation physiologique normale en provoquant d'abord un rattrapage statural, puis en assurant une vitesse de croissance normale jusqu'à l'arrivée de la taille adulte. Ainsi le résultat d'un traitement destiné à corriger un retard de croissance peut être évalué avec précision. Le critère d'efficacité essentiel est l'amélioration de la taille définitive de l'enfant, et non pas une simple accélération transitoire de croissance. Fort heureusement, sans attendre la fin de la croissance, on peut chiffrer cette amélioration par des calculs successifs de la taille adulte prédite. On utilise pour cela diverses méthodes (de Bailey et Pinneau, Roche ou Tanner).
La croissance de rattrapage est caractéristique de la puissance des phénomènes naturels de correction. Chez un enfant dont la croissance est ralentie par une maladie ou une cause extérieure telle que la dénutrition, la suppression totale du mécanisme pathogène permet une reprise immédiate et durable de la croissance. Celle-ci reste très forte jusqu'au moment où la taille de l'enfant est revenue dans la zone qui lui est génétiquement (taille des parents) assignée. On parle alors de phénomène de rattrapage. Son mécanisme n'est probablement pas hormonal mais comporte sans doute des signaux cellulaires propres à chaque organe. Cette accélération de croissance est d'ailleurs le meilleur témoin d'efficacité d'un traitement.
Pathologie de la puberté
L' influence de la pathologie de la puberté sur la croissance est importante et plusieurs exemples peuvent être cités :
– absence de puberté (hypogonadisme primaire ou secondaire à un déficit hypophysaire en LH) : la croissance est prolongée mais la taille définitive n'est pas modifiée ;
– retard de puberté (fréquent chez le garçon) : la croissance est transitoirement ralentie jusqu'à l'arrivée de la puberté qui permet le retour à une croissance normale avec rattrapage du retard statural ;
– puberté précoce (déclenchement prématuré du mécanisme neuro-endocrinien de la puberté) : l'accélération de croissance accompagnée d'une rapide progression de maturation osseuse risque de conduire à une petite taille définitive ;
– absence d'hormone de croissance pendant la puberté (insuffisance hypophysaire) : la poussée de croissance pubertaire ne peut pas avoir lieu.
Le traitement de ces diverses situations a pour but de restaurer une évolution normale pour l'âge de l'enfant et de maintenir l'équilibre physiologique entre hormone de croissance et hormones sexuelles, qui est nécessaire à la croissance pubertaire.
Influence des troubles nutritionnels
Le système endocrinien assure l'adaptation de la croissance à la disponibilité énergétique. En freinant la croissance lors de situations de carence nutritionnelle, l'organisme réussit à préserver les ressources énergétiques nécessaires aux fonctions métaboliques vitales et à l'activité cérébrale. À la limite, on pourrait considérer que le retard de croissance est le prix à payer pour permettre la survie de l'enfant dénutri.
La dénutrition chronique provoque en effet des changements endocriniens caractéristiques : résistance cellulaire à l'hormone de croissance, diminution de la somatomédine, diminution des hormones thyroïdiennes (syndrome de triiodothyronine [T3] basse) et retard pubertaire (cf. dénutrition).
Les principales causes de dénutrition affectant la croissance sont : la sous-alimentation (marasme), la malabsorption digestive due à la maladie cœliaque et à l'iléite de Crohn, et l'anorexie mentale. En fait, toute maladie chronique grave retentissant sur l'alimentation peut être facteur de dénutrition.
Une forme particulière de sous-nutrition survient dans les situations de carence affective chronique (nanisme psychosocial). À la privation alimentaire s'ajoutent des troubles affectifs graves. Tous deux peuvent provoquer un retard sévère de la croissance. La suppression de ces troubles, en éloignant éventuellement l'enfant de son milieu familial pathogène, s'accompagne alors d'une reprise spectaculaire de la croissance staturale.
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- André MAYRAT : sous-directeur du laboratoire de zoologie de l'École normale supérieure, Paris
- Raphaël RAPPAPORT : professeur de biologie du développement et de la reproduction, chef de l'unité d'endocrinologie pédiatrique et du diabète à l'hôpital des Enfants malades, directeur de l'unité de recherche I.N.S.E.R.M. sur la biologie de la croissance
- Paul ROLLIN : professeur à la faculté des sciences de Rouen
- Encyclopædia Universalis : services rédactionnels de l'Encyclopædia Universalis
Classification
Médias
Autres références
-
MITOSE
- Écrit par Nina FAVARD
- 6 522 mots
- 5 médias
Pendant les périodes decroissance cellulaire (surtout la phase G1 du cycle cellulaire), le nombre des organites s'accroît en même temps que la taille de la cellule. Leurs mouvements, guidés par les microtubules, les distribuent topographiquement dans le cytoplasme dont le volume augmente. Cette distribution... -
AGROMÉTÉOROLOGIE
- Écrit par Emmanuel CHOISNEL et Emmanuel CLOPPET
- 6 628 mots
- 7 médias
...restriction hydrique sévère au cours de cette période critique peut occasionner des baisses de rendements allant jusqu'à 50 p. 100 du poids des grains. On définit également des périodes sensibles à l'égard de la croissance. Ainsi, la betterave sucrière est une plante réputée très sensible à l'eau. Toute... -
AMINOACIDES INDISPENSABLES
- Écrit par Geneviève DI COSTANZO
- 601 mots
Au début du xxe siècle, les recherches de Wilcock et de Hopkins montrèrent que certaines protéines (gélatine, zéine) sont incapables, malgré un apport azoté quantitativement suffisant, de maintenir l'équilibre nutritif de l'animal et d'assurer sa croissance. L'adjonction à ce régime de certains...
-
ANIMAUX MODES DE REPRODUCTION DES
- Écrit par Catherine ZILLER
- 4 448 mots
- 4 médias
La reproduction asexuée ne se déclenche que lorsque l'animal atteint une certaine taille. Elle est la conséquence de la croissance. Il en est ainsi pour l'hydre, qui commence à produire des bourgeons quand la colonne gastrique, qui est en perpétuelle croissance, a une longueur suffisante. - Afficher les 57 références
Voir aussi
- MALNUTRITION
- ALLOMÉTRIE, biologie
- IMMORTALITÉ POTENTIELLE, biologie
- TESTOSTÉRONE
- THYROÏDIENNES HORMONES
- MORPHOGENÈSE ANIMALE
- SACCULINE
- ENDOCRINE SÉCRÉTION
- RELEASING FACTORS (RF)
- ANTÉHYPOPHYSE
- POÏKILOTHERMIE ou PŒCILOTHERMIE
- SOMATOTROPE HORMONE (STH) ou HORMONE DE CROISSANCE ou GH (growth hormone)
- GIGANTISME
- ACROMÉGALIE
- PARATHORMONE
- CORTISOL ou HYDROCORTISONE
- GLUCOCORTICOÏDES
- HORMONOTHÉRAPIE
- ESTRADIOL ou ŒSTRADIOL
- CHITINE
- CRABE
- PUBERTÉ
- PÉRIOSTE
- VÉGÉTALE BIOLOGIE
- CORTICOÏDES ou CORTICOSTÉROÏDES
- ORGANOGENÈSE
- ENFANT MALADIES DE L'
- GRADIENT, biologie
- PÉDIATRIE
- PHYSIOLOGIE
- RENOUVELLEMENT BIOLOGIQUE
- SEXUEL COMPORTEMENT
- MÉTABOLISME CELLULAIRE
- CUSHING MALADIE DE
- SEXUELLES HORMONES
- CHROMOPROTÉINES
- MÉRÉSIS, biologie végétale
- TEMPÉRATURE
- VRILLE, botanique
- TRIIODOTHYRONINE (T3)
- HYPOTHYROÏDIE
- INSUFFISANCE ANTÉHYPOPHYSAIRE ou HYPOPITUITARISME
- DORMINE ou ABSCISSINE II
- REPRODUCTION SEXUÉE
- REPRODUCTION ASEXUÉE
- GERMEN, biologie
- CIRCUMNUTATION
- MUE
- VITAMINES D ou CALCIFÉROLS
- MÉTAZOAIRES
- ARAIGNÉE DE MER
- EXUVIATION
- CARTILAGE DE CONJUGAISON ou CARTILAGE DE CROISSANCE
- SOMA, biologie
- DIVISION CELLULAIRE
- INSULINE
- CULTURES BIOLOGIQUES
- ISOMÉTRIE, biologie
- CAMBIUMS ou ASSISES GÉNÉRATRICES ou MÉRISTÈMES SECONDAIRES
- CYTOKININES
- INDOLE-3-ACÉTIQUE ACIDE (AIA)
- QUIESCENCE
- PHLOÈME ou LIBER, botanique
- LARVE
- OSSIFICATION ou OSTÉOGENÈSE
- RÉCEPTEURS HORMONAUX
- UNICELLULAIRES
- NEUROENDOCRINOLOGIE
- CHRONOBIOLOGIE
- BERTALANFFY LUDWIG VON (1901-1972)
- PHYSIOLOGIE VÉGÉTALE ou PHYTOBIOLOGIE
- DIFFÉRENCIATION CELLULAIRE ou CYTODIFFÉRENCIATION
- EMBRYOGENÈSE ANIMALE
- DÉVELOPPEMENT HUMAIN
- MESSAGER, biochimie
- MORPHOLOGIE, biologie
- NUTRITION HUMAINE
- RÉGULATIONS BIOCHIMIQUES
- AUXÉSIS, biologie végétale
- CORTICOTHÉRAPIE
- EXOSQUELETTE
- CROISSANCE HUMAINE
- SQUELETTE HUMAIN
- FACTEURS DE CROISSANCE
- TAILLE CORPORELLE
- EXUVIE
- SOMATOMÉDINE
- IGF (insulin-like growth factor)
- ÉNANTIOMÉTRIE
- RETARD DE CROISSANCE
- POIDS CORPOREL