CUIVRE
Article modifié le
Propriétés du cuivre
Les propriétés du cuivre sont données dans le tableau 1.
Propriétés physiques et mécaniques
Le cuivre cristallise dans le système cubique à faces centrées (a = 0,366 nm). C'est, après l'argent, le meilleur conducteur de la chaleur et de l'électricité, mais cette conductivité est très affectée par les éventuelles impuretés (phosphore, arsenic et aluminium notamment). Les atomes étrangers déforment le réseau et rendent plus difficile le transport des électrons.
Les caractéristiques mécaniques du métal pur sont moyennes ; elles le situent loin derrière l'acier, mais avant les métaux mous (zinc, plomb, étain). Sa dureté est 3 dans l'échelle de Mohs, la résistance à la traction est faible et l'allongement important. Les propriétés mécaniques du cuivre sont assez favorables à la mise en forme à chaud et à froid.
Le cuivre et ses alliages présentent cette intéressante particularité que leurs caractéristiques mécaniques s'améliorent lorsque la température baisse. De là leur utilisation comme matériaux cryotechniques dans l'industrie des gaz liquéfiés.
Du côté des hautes températures, au contraire, ils présentent deux inconvénients : la résistance à l'oxydation décroît avec la température et les caractéristiques mécaniques diminuent dès 200 0C pour le cuivre pur. Les cupronickels et les cupro-aluminiums sont, parmi les alliages de cuivre, ceux qui résistent le mieux aux températures élevées. Pour ces alliages, la température limite est de l'ordre de 400 à 500 0C selon le temps qu'ils demeurent à ces températures. Lorsqu'il faut associer résistance à la température et conductivité électrique, par exemple, on peut utiliser des matériaux composites.
Propriétés chimiques
Le cuivre précède l'argent et l'or dans le sous-groupe b de la première colonne du tableau périodique des éléments. Neuvième des dix éléments de transition compris entre le calcium et le gallium, il est le premier à posséder une sous-couche 3 d complète. L'arrangement des électrons implique que le cuivre est normalement monovalent, et les sels cuivreux ressemblent en effet aux sels d'argent, auxquels ils sont souvent mêlés dans la nature. L'oxyde, le sulfure et les halogénures cuivreux ont une structure covalente prédominante. Ils cristallisent dans le système cubique du type de celui de la blende. Les halogénures sont facilement fusibles et sont semi-conducteurs. L'ion Cu+ est incolore et diamagnétique. En raison de son rayon important (0,091 nm), il ne donne pas d'hydrates et ses complexes sont peu stables. D'une façon générale, les sels cuivreux sont instables en solution en raison de l'équilibre :

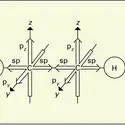
Les sels cuivriques anhydres cristallisés sont diversement colorés, mais la solution ammoniacale d'un sel cuivrique est toujours d'un beau bleu foncé, coloration caractéristique des ions [Cu (NH3)n]2+ ; les hydrates ont une couleur bleue ou verte. Très stables, les complexes cuivriques (hydrates, ammines) sont tous paramagnétiques lorsqu'ils ont un électron célibataire et ont une structure dsp2.
Métal noble, le cuivre, à l'inverse du fer, du zinc et du plomb, ne déplace pas l'hydrogène de ses solutions, et n'est donc pas soluble dans les hydracides. Il est soluble, en revanche, dans les acides oxydants (acide nitrique, acide sulfurique concentré et chaud). L'ammoniaque le dissout également en donnant une solution bleue connue sous le nom de « liqueur de Schweitzer ».
Le cuivre résiste bien à la corrosion atmosphérique et marine ; une longue exposition entraîne la formation d'une fine couche de carbonate basique d'un beau vert. C'est la patine de certains toits.
Propriétés biochimiques
Le cuivre est, comme le fer, un élément indispensable à de nombreux processus vitaux. Il est le coenzyme de nombreuses métalloprotéines comme l'acide ascorbique oxydase et la tyrosinase. Mais son rôle principal est la stimulation de la synthèse de l'hémoglobine.
Ce rôle biologique du cuivre est probablement dû à la solidité des chélates qu'il forme avec les substances biologiques actives et à ses propriétés catalytiques intrinsèques.
Ses propriétés oxydoréductrices expliquent que les cupro-enzymes interviennent dans la chaîne respiratoire (au niveau de la cytochrome-oxydase probablement).
Les aliments contiennent naturellement du cuivre en quantité suffisante aux besoins de l'être humain ; le corps en contient environ 12 milligrammes par kilogramme.
L'eau potable peut contenir du cuivre ; au-dessus de 1,5 mg/l, certaines personnes particulièrement sensibles peuvent constater un goût. À très faibles teneurs, les sels de cuivre présentent une saveur désagréable très marquée rendant impossible l'ingestion involontaire de quantités toxiques.
Si le cuivre (à très faible dose) joue un rôle bénéfique vis-à-vis des organismes supérieurs, son comportement est totalement différent vis-à-vis des formes de vie inférieures ; c'est le métal bactéricide le plus actif : un gramme de cuivre peut détruire jusqu'à 5 000 grammes de dangereux micro-organismes comme les colibacilles ou les staphylocoques dorés.
L'emploi de matériaux cuivreux dans les cliniques et dans tous les édifices publics améliorerait la prophylaxie des infections.
Composés du cuivre
Le cuivre est moins utilisé sous forme de sel que sous forme métallique. Le métal à l'état pur présente des propriétés de catalyseur mises à profit par certaines industries, la pétroléochimie notamment.
Le plus employé des sels de cuivre est le sulfate, qui est à la base de la bouillie bordelaise, dans laquelle l'acidité du sulfate est neutralisée par de la chaux. Ce produit est employé en agriculture et en viticulture. On lui substitue parfois la bouillie bourguignonne, dans laquelle la chaux est remplacée par du carbonate de calcium. L' oxychlorure de cuivre associé à d'autres produits de synthèse tend à se substituer au sulfate.
Il semble que l'effet du cuivre soit non seulement fongicide, mais aussi nécessaire à la croissance de nombreuses plantes. Cela est mis en évidence par le fait que des sols stériles, par suite de carence en cuivre, ont pu être mis en production par l'addition d'engrais contenant du cuivre. Les carences en cuivre peuvent également se traduire dans les prés par le dépérissement des animaux qui y pâturent. L'addition de quelques kilogrammes de sulfate de cuivre à l'hectare y remédie parfaitement.
Les sels de cuivre servent en outre à protéger les bois contre la pourriture, à protéger les semences, à l'enduction de certains tissus, à fabriquer des peintures antifouling retardant la fixation d'organismes marins sur les coques de navires. Ils sont très utilisés dans les bains d'électrolyse pour cuivrage d'aciers ou d'autres métaux.
Une application peu connue des sels de cuivre consiste dans l'utilisation de sulfate de cuivre comme additif aux aliments des porcs. L'addition de 250 p.p.m. à ces aliments entraîne une augmentation plus rapide du poids de l'animal, et plusieurs centaines de tonnes sont utilisées annuellement en France à cet effet. Le cuivre est trop souvent considéré comme un métal toxique. En fait, il n'existe pas de maladie professionnelle du cuivre. Nécessaire à la vie, ce métal semble jouer un rôle important dans la formation de l'hémoglobine du sang. Le docteur Kohei Toyokawa, de la faculté de médecine de Tōkyō, a pu mettre en évidence l'influence favorable du cuivre sur le développement de l'animal.
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- C.I.C.L.A. : Centre d'information cuivre, laitons, alliages
- Jean-Louis VIGNES : professeur d'université à l'I.U.F.M. de Créteil, chercheur au Centre d'études de chimie métallurgique (C.N.R.S.)
Classification
Médias
Autres références
-
ALCYNES
- Écrit par Jacques METZGER
- 3 302 mots
- 5 médias
-
ALLIAGES
- Écrit par Jean-Claude GACHON
- 7 363 mots
- 5 médias
La figure concerne le systèmecuivre (Cu)- tungstène (W). L'axe des abscisses représente la teneur de l'alliage en tungstène exprimée en atomes pour cent ou en poids pour cent ; la première échelle est utilisée dans les laboratoires de recherche tandis que la seconde est celle des industriels, qui... -
ANTOFAGASTA
- Écrit par Hélène LAMICQ
- 203 mots
- 1 média
Située dans le nord du Chili à 230 5 de latitude sud, Antofagasta est la capitale de la province du même nom. Après l'annexion du désert d'Atacama par le Chili en 1883, la ville ne connut un réel essor qu'après la mise en exploitation des énormes gisements de cuivre de l'intérieur...
-
ARCHAÏQUE, Amérique du Nord
- Écrit par Patrick PLUMET
- 2 404 mots
- 3 médias
Ce faciès, aussi mal défini que mal délimité géographiquement,est caractérisé par l'utilisation du cuivre natif provenant du bassin du lac Supérieur, surtout dans le Wisconsin. Des objets martelés dans ce cuivre imitent les formes des outils en ardoise polie de l'Archaïque laurentien et de l'Archaïque... - Afficher les 46 références
Voir aussi
- RAFFINAGE, métallurgie
- COULÉE, technologie
- SULFURES
- SELS
- CUPRONICKELS
- MARCHÉ CONTRÔLE DE
- MATIÈRES PREMIÈRES
- RECYCLAGE DES DÉCHETS ET DES MATÉRIAUX
- HAUT-FOURNEAU
- GISEMENTS MÉTALLIFÈRES
- CUPROALUMINIUMS
- ANTIFRICTION ALLIAGES
- AFFINAGE, métallurgie
- FLOTTATION
- PURIFICATION, physico-chimie
- OXYDATION
- SULFATES
- SCHWEITZER LIQUEUR DE
- DWIGHT & LLOYD MACHINE DE
- BRASAGE
- CHALCOPYRITE
- BORNITE
- BLISTER
- DÉCOLLETAGE
- EMBOUTISSAGE
- MOULAGE
- RÉSISTANCE À LA CORROSION
- SOUDAGE
- WATERJACKET
- PERCHAGE
- TRÉFILAGE
- LAMINAGE
- MATRIÇAGE, métallurgie
- LAITONS
- MAILLECHORTS
- OXYCHLORURES
- BARRE, métallurgie
- TUBE
- ÉLECTROMÉTALLURGIE
- FOURS
- LONDON METAL EXCHANGE
- CONCASSAGE
- ENRICHISSEMENT, technologie
- TRANSITION MÉTAUX DE
- BRONZES
- FONDERIE
- ÉLECTROLYSE
- USINAGE
- PROFILÉS
- FILAGE, métallurgie