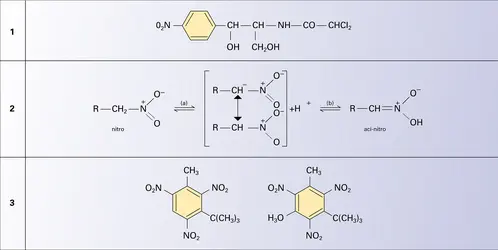
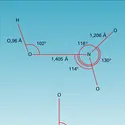
NITRÉS DÉRIVÉS
On appelle dérivés nitrés des composés organiques dont la formule comporte au moins un groupe fonctionnel −NO2 lié à un atome de carbone qui peut être saturé, éthylénique ou aromatique. La structure électronique de cette fonction correspond à un système de deux doublets partagés entre les trois atomes dont la conjugaison rend symétrique la distribution et équivalents les deux atomes d'oxygène. Son écriture implique deux formules limites de poids identiques :
O=N+−O- ↔ O-−N+=O.||
La fonction simple nitro ne se rencontre pas dans les produits naturels : elle intervient cependant dans de rares composés à fonction mixte comme l'antibiotique chloromycétine (formule). Les dérivés nitrés constituent des intermédiaires de synthèse très importants, car leur réduction est une des meilleures préparations des amines aromatiques (synthèse de l'aniline par réduction du nitrobenzène) ; certains ont un intérêt par eux-mêmes ; quelques-uns sont des parfums, beaucoup sont des explosifs.
Préparations
Nitroalcanes. La nitration directe des hydrocarbures saturés par l'acide nitrique se produit en phase gazeuse à température élevée (400-500 0C) avec un temps de réaction très court. Les premiers termes de la série des nitroalcanes primaires sont ainsi élaborés industriellement. La préparation fait intervenir à la fois un craquage thermique de l'hydrocarbure et une réaction radicalaire en chaîne des fragments formés avec l'acide nitrique moléculaire. On obtient des mélanges de nitroalcanes que l'on sépare par distillation.
Les alcanes moyens linéaires sont nitrés en phase liquide par ébullition avec un acide nitrique moyennement concentré. La réaction n'est pas sélective mais les mélanges ainsi formés sont difficiles à séparer.
Au laboratoire, on prépare les nitroalcanes primaires et secondaires par chauffage du bromure ou de l'iodure d'alkyle correspondant, avec le nitrite de sodium dans le diméthylformamide ; on obtient un mélange, en proportions sensiblement équivalentes, du nitroalcane et de son isomère nitrite d'alkyle, facile à séparer par distillation fractionnée :

Cette double orientation de la réaction de substitution de l'halogène par le réactif nucléophile nitrite est liée au caractère ambident de ce dernier, qui peut réagir soit par un atome d'oxygène (nucléophile dur), soit par l'azote central (nucléophile moyen), sur le site carboné (électrophile moyen à mou selon la nature de l'halogène).
Le nitrométhane est préparé par chauffage de l'acide chloracétique avec une solution aqueuse de nitrite de sodium : l'acide nitroacétique formé subit instantanément une décarboxylation qui conduit au nitrométhane :
Le tétranitrométhane résulte de l'action, à froid, de l' acide nitrique fumant sur l'anhydride acétique.
Nitroalcènes. En dehors du nitrostyrène, obtenu par action de l'acide nitrique sur le vinylbenzène, les nitroalcènes proviennent normalement de la facile déshydratation des alcools α-nitrés, eux-mêmes formés par condensation du nitrométhane en milieu faiblement alcalin sur des dérivés carbonylés :
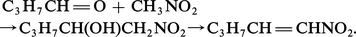
Nitroarènes. Les hydrocarbures aromatiques sont nitrés par un mélange d'acides nitrique et sulfurique dans des conditions de concentrations et de température qui dépendent de la réactivité du substrat. La présence sur ce dernier de substituants alkyle ou de groupes fonctionnels électro-donneurs par conjugaison (phénols, amines) active la réaction.
Le premier groupe nitro introduit dans la molécule la désactive et rend plus difficile une seconde nitration. L'acide nitrique fumant ou le mélange acide nitrique ordinaire- acide sulfurique, au-dessous de 20 0C, ne nitrent le benzène qu'une seule fois. La solution acide nitrique fumant-acide sulfurique provoque, dès 20 0C, une double[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
Classification
Média
Autres références
-
COLORANTS
- Écrit par Daniel FUES
- 6 775 mots
- 4 médias
Les colorantsnitrés forment une classe de colorants très limitée en nombre et relativement ancienne, puisque l'acide picrique en est historiquement le premier représentant. Ils sont actuellement encore utilisés, du fait de leur prix très modéré lié à la simplicité de leur structure moléculaire. Cette... -
CRÉSOL
- Écrit par Bernard BACH
- 213 mots
Mélange des trois isomères du méthylphénol (CH3—C6H4OH) en position ortho-, méta- et para-, qui sont tous d'odeur désagréable, mais moins toxiques que le phénol ordinaire. Les créosols sont des antiseptiques puissants.
À partir du mélange des trois isomères (acide crésylique), on...
-
NITRIQUE ACIDE
- Écrit par Jean ROUXEL
- 1 605 mots
- 4 médias
Les dérivés nitrés sont très importants, citons :