NITRÉS DÉRIVÉS
Propriétés physiques et applications
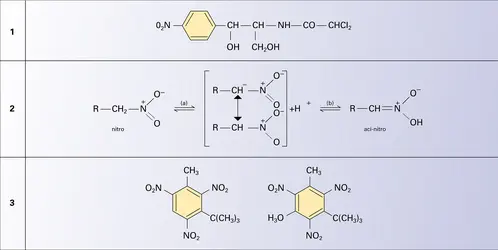
Les dérivés nitrés sont des molécules associées par interaction dipolaire, ce qui explique leur température d'ébullition relativement élevée dès les premiers termes ; le nitrométhane bout à 102 0C ; le nitrobenzène à 211 0C ; leur moment électrique permanent étant respectivement de 3,46 et 3,95 debyes. La permittivité élevée des dérivés nitrés liquides en fait de bons solvants aprotiques polaires. Les premiers termes des nitroalcanes primaires sont utilisés comme tels pour la dissolution des résines de polyvinyle, de polystyrène et de polyacrylonitrile. Le spectre infrarouge est caractérisé par deux bandes vers 1 600 et 1 450 cm-1.
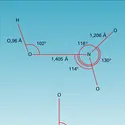
Le nitrométhane est faiblement soluble dans l'eau ; cette solubilité diminue pour les homologues et le nitrobenzène est déjà pratiquement insoluble. À la différence des dérivés tertiaires, les nitroalcanes primaires et secondaires se dissolvent lentement dans une solution de soude avec formation d'un sel ; ces propriétés acides sont dues, d'une part, à l'effet électro-attracteur du groupe nitro qui rend pseudo-acide l'hydrogène porté par le carbone voisin et, d'autre part, à la conjugaison du carbanion formé par arrachement de ce proton (réaction a). Le pKA du nitrométhane est de 10,2, celui du nitro-2 propane de 7,8. L'anion de la base conjuguée est ambident (c'est-à-dire qu'il présente deux sites de réactivité nucléophile) et sa charge négative est partagée entre le carbone porteur du groupe nitro et l'oxygène de celui-ci. Cette situation est semblable à celle d'un anion énolate et, comme dans le cas de ce dernier, la reprotonation se produit au niveau du site basique dur, c'est-à-dire de l'oxygène, et conduit à une molécule isomère appelée aci-nitro, analogue de l'énol (réaction b). Lorsque cette dernière présente une conjugaison complémentaire, comme dans le cas du phénylnitrométhane C6H5CH2NO2, elle peut être isolée sous une forme métastable (tf = 84 0C), qui peu à peu redonne l'isomère normal nitro (téb = 225 0C). En solution dans le méthanol aqueux, le paranitrophénylnitrométhane se trouve en équilibre avec 0,8 p. 100 de son isomère ; cette proportion est de 16 p. 100 en solution dans la pyridine.
Le nitrobenzène possède une odeur qui rappelle celle des amandes amères ; résistant aux alcalis, il est parfois utilisé sous le nom d'essence de mirbane pour parfumer des savons bon marché.
Plusieurs alkylbenzènes trinitrés qui renferment un groupe tertiobutyle ont une odeur musquée et sont utilisés en parfumerie sous le nom de musc-toluène et de musc-xylène (formules).
Les dérivés polynitrés des cycles aromatiques sont des explosifs de sécurité, principalement employés en artillerie ; peu sensibles au choc, ils ne détonnent que sous l'influence d'une forte amorce de fulminate de mercure ou de nitrure de plomb. Le plus connu est le trinitro-2,4,6 toluène (T.N.T.) ou tolite qui, fondant à 81 0C, est facile à manipuler ; il sert de standard pour la mesure du pouvoir de destruction des autres explosifs. Le trinitro-2,4,6 phénol ou acide picrique est un explosif plus puissant que le T.N.T. ; son sel d'ammonium a été utilisé comme explosif retard dans les obus perce-blindage.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
Classification
Média
Autres références
-
COLORANTS
- Écrit par Daniel FUES
- 6 775 mots
- 4 médias
Les colorantsnitrés forment une classe de colorants très limitée en nombre et relativement ancienne, puisque l'acide picrique en est historiquement le premier représentant. Ils sont actuellement encore utilisés, du fait de leur prix très modéré lié à la simplicité de leur structure moléculaire. Cette... -
CRÉSOL
- Écrit par Bernard BACH
- 213 mots
Mélange des trois isomères du méthylphénol (CH3—C6H4OH) en position ortho-, méta- et para-, qui sont tous d'odeur désagréable, mais moins toxiques que le phénol ordinaire. Les créosols sont des antiseptiques puissants.
À partir du mélange des trois isomères (acide crésylique), on...
-
NITRIQUE ACIDE
- Écrit par Jean ROUXEL
- 1 605 mots
- 4 médias
Les dérivés nitrés sont très importants, citons :