DÉTERMINATION DE LA STRUCTURE 3D DES PROTÉINES
Article modifié le
La biologie moléculaire, branche de la biologie contemporaine, étudie les mécanismes qui assurent les fonctions du vivant. Les structures tridimensionnelles (3D) des macromolécules en jeu sont à la base de toute interaction moléculaire, élément fondamental de ces mécanismes. Leur caractérisation est l’objet de la biologie structurale.
Les cibles de la biologie structurale
Comprendre la relation entre la structure d’une macromolécule – déterminée à une résolution quasi atomique – et sa fonction constitue un enjeu fondamental tant sur le plan de la connaissance de base que sur celui des applications. Par exemple, la détermination de la célèbre structure en double hélice de l’ADN, en 1953, a entièrement renouvelé notre compréhension de la génétique. Autre exemple, lors de la pandémie de la Covid-19, la détermination au niveau atomique de la structure de la protéine virale qui se fixe à la cellule et celle de son récepteur sur cette dernière ont participé à la mise au point des vaccins à ARN messager qui ont largement contribué à limiter la diffusion de la maladie. Plus généralement, les mécanismes du vivant sont liés à une multitude d’interactions précises entre structures tridimensionnelles.
La cible principale de la biologie structurale est la conformation dans l’espace des protéines et des complexes dans lesquelles elles sont engagées. Une protéine est une suite d’acides aminés assemblés les uns aux autres selon un ordre dicté par leur gène, ce que l’on appelle la structure primaire. Au cours de leur synthèse dans le cytoplasme cellulaire, les protéines tendent à se replier dans l’espace spontanément, même si certaines ont besoin de « chaperonnes », d’autres protéines ayant pour rôle d’assister leur repliement lors de leur synthèse : celui-ci est en effet déterminé par la séquence des acides aminés qui présentent différentes propriétés physiques (polarité, hydrophobicité, charge…) permettant des interactions entre eux. Dans le repliement, on distingue différents niveaux de structure : la structure secondaire désigne des hélices, feuillets, coudes, etc., dont la stabilité est, dans la majorité des cas, assurée par des liaisons faibles en énergie. Ces éléments de structure secondaire se replient eux-mêmes en domaines structuraux : on parle de structure tertiaire. Une protéine peut être encore formée d'un ou plusieurs domaines. Elle peut aussi s’associer en des édifices plus complexes, composés de plusieurs sous-unités, ou faire partie, avec l’ARN, d’organelles comme les ribosomes. On parle alors de structure quaternaire. Il est à noter que certaines protéines peuvent adopter différentes conformations, et que des protéines sont complètement ou partiellement désordonnées et pourtant capables d'interagir avec leurs partenaires pour exercer une fonction. Comment déterminer expérimentalement ces différents niveaux de structures ?
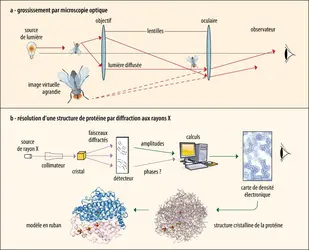
La réponse a été apportée par des approches physiques. Comme déjà mentionné, après la Seconde Guerre mondiale, en 1953, l’utilisation de la diffraction aux rayons X a permis de définir au niveau atomique la structure spatiale de la double hélice de l’ADN et, en 1958, la structure 3D d’une petite protéine, la myoglobine. Les premières décennies, le nombre de structures déterminées a progressé lentement. En 1971, le laboratoire national de Brookhaven (État de New York) a fondé une banque de données des protéines appelée Protein Data Bank (PDB), qui ne comptait à l’époque que les coordonnées atomiques de sept structures. Depuis les années 1980, le nombre de structures déterminées expérimentalement n’a cessé de croître dans des proportions considérables – à titre indicatif, notons qu’au cours de l’année 2024 la PDB en comporte environ 222 000.
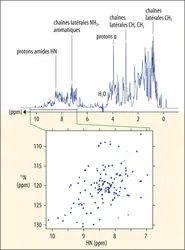
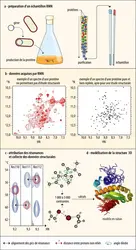
Depuis les années 1980, deux autres méthodes expérimentales, la[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Beate BERSCH : chargée de recherche au CNRS
- Juan FONTECILLA-CAMPS : conseiller scientifique au CEA
- Emmanuelle NEUMANN : docteure en physique, ingénieure-chercheuse au CEA Grenoble
Classification
Médias
Voir aussi
- FRÉQUENCE, physique
- CONGÉLATION
- NOYAU ATOMIQUE
- MICROSCOPIE ÉLECTRONIQUE
- MICROSCOPIE ÉLECTRONIQUE À BALAYAGE EN TRANSMISSION
- INTERACTIONS MOLÉCULAIRES
- STRUCTURE, biologie
- RMN (résonance magnétique nucléaire), physico-chimie
- CRISTALLOGRAPHIE
- DIFFRACTION PAR LES CRISTAUX
- BIOLOGIE MOLÉCULAIRE
- HÉLICE, chimie des protéines
- LARMOR FRÉQUENCE DE
- MICROSCOPIE ÉLECTRONIQUE À BALAYAGE
- MOLÉCULES BIOLOGIQUES, structure et fonction
- MACROMOLÉCULES BIOLOGIQUES
- ISOTOPES, biologie
- TOMOGRAPHIE
- PROTÉINES
- BIOLOGIE HISTOIRE DE LA
- IMAGE ou REPRÉSENTATION TRIDIMENSIONNELLE (3D)