DÉTERMINATION DE LA STRUCTURE 3D DES PROTÉINES
Article modifié le
La cryomicroscopie électronique
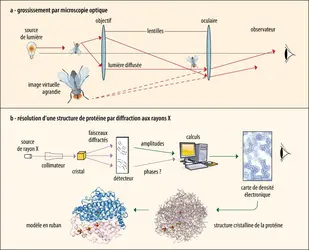
Si l’histoire du microscope optique débute à la fin du xvie siècle, celle du microscope électronique remonte au début du xxe siècle. En 1931, les premières images obtenues avec un microscope électronique révèlent une résolution de quelques dizaines de nanomètres (nm), franchissant ainsi les limites fondamentales de la microscopie optique, qui possède un pouvoir résolutif de quelques centaines de nanomètres. L’explication d’une telle différence est intrinsèquement liée à la nature de la source de « lumière » : en microscopie optique (ou photonique), les longueurs d’onde couvertes par le spectre du visible sont comprises entre 380 et 780 nm et permettent d’accéder à une résolution maximale de l’ordre de 200 nm ; en microscopie électronique, les électrons ont des longueurs d’onde de l’ordre de quelques picomètres (1 pm = 10–3 nm) et ouvrent donc théoriquement la possibilité d’une résolution atomique de 0,1 nm (1 Å). Tout au long du xxe siècle, d’importants développements (à la fois techniques et instrumentaux) ont été réalisés afin de passer d’une résolution de quelques dizaines de nanomètres à quelques nanomètres jusqu’à une résolution pseudo-atomique.
Tout microscope électronique est composé d’une source de rayonnement lumineux (les électrons), d’une optique constituée de plusieurs lentilles électromagnétiques (condenseurs, objectif, projecteurs…) et d’un détecteur permettant l’observation et l’enregistrement de l’image (écran fluorescent, plans-films, caméra…). Selon la nature et l’épaisseur de l’objet à observer, ce dernier peut être observé en transmission (échantillon d'épaisseur < 200 nm, « transparent » à la lumière) ou en réflexion (échantillon épais, ayant un pouvoir réfléchissant). Il existe également deux grandes familles de microscopes électroniques : les microscopes conventionnels, qui se caractérisent par un faisceau fixe et une optique après l’échantillon (constituée des lentilles objectif, intermédiaires et projecteurs), pour l’obtention d’une image agrandie ou un cliché de diffraction de l’échantillon ; les microscopes à balayage (MEB) qui possèdent un faisceau mobile (sonde) et aucune optique après l’échantillon. Avec les MEB, l’image est obtenue à la suite d'un balayage séquentiel de la sonde sur l’échantillon et la synchronisation de divers signaux enregistrés sur différents détecteurs.
L'enjeu originel de la microscopie électronique était l’observation d’un échantillon sous vide (pour éviter toute dispersion des électrons) et sous un faisceau d’électrons (qui détruit l’échantillon). Pour pallier cette double contrainte en biologie, des techniques adaptées de préparation d’échantillons ont été développées.
Dans le cas d’échantillons biologiques d’épaisseur supérieure à 200 nm, comme des cellules ou des tissus biologiques, des préparations spécifiques ont émergé selon l’information recherchée : si celle-ci concerne la surface de l’échantillon, des techniques de fixation (afin de préserver les tissus), de déshydratation et de métallisation sont appliquées pour une analyse au microscope électronique à balayage ; s’il s’agit d’une information portant sur l’ultrastructure de l’échantillon dans son épaisseur, des techniques de fixation (chimique ou par congélation sous haute pression), d’inclusion en résine et de coupes par microtomie et ultramicrotomie sont appliquées pour une analyse en imagerie classique au microscope électronique à transmission (MET). Une autre technique (CEMOVIS), qui préserve l’état natif des tissus, consiste à congeler ceux-ci à très basse température (≤ –180 °C), puis à réaliser à basse température des cryocoupes ultraminces (25 à 50 nm), qui sont également observées en imagerie classique au MET sous de faibles doses d’électrons.[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Beate BERSCH : chargée de recherche au CNRS
- Juan FONTECILLA-CAMPS : conseiller scientifique au CEA
- Emmanuelle NEUMANN : docteure en physique, ingénieure-chercheuse au CEA Grenoble
Classification
Médias
Voir aussi
- FRÉQUENCE, physique
- CONGÉLATION
- NOYAU ATOMIQUE
- MICROSCOPIE ÉLECTRONIQUE
- MICROSCOPIE ÉLECTRONIQUE À BALAYAGE EN TRANSMISSION
- INTERACTIONS MOLÉCULAIRES
- STRUCTURE, biologie
- RMN (résonance magnétique nucléaire), physico-chimie
- CRISTALLOGRAPHIE
- DIFFRACTION PAR LES CRISTAUX
- BIOLOGIE MOLÉCULAIRE
- HÉLICE, chimie des protéines
- LARMOR FRÉQUENCE DE
- MICROSCOPIE ÉLECTRONIQUE À BALAYAGE
- MOLÉCULES BIOLOGIQUES, structure et fonction
- MACROMOLÉCULES BIOLOGIQUES
- ISOTOPES, biologie
- TOMOGRAPHIE
- PROTÉINES
- BIOLOGIE HISTOIRE DE LA
- IMAGE ou REPRÉSENTATION TRIDIMENSIONNELLE (3D)