DISTILLATION
Article modifié le
La distillation est une des méthodes de séparation les plus importantes dont on dispose pour résoudre un mélange en ses divers constituants. Elle est fondée sur le fait qu'une phase vapeur surmontant un liquide bouillant et en équilibre avec ce dernier n'en a pas la même composition. En recueillant séparément, d'une part, le liquide et, d'autre part, la vapeur que l'on refroidit et condense, on obtient deux liquides différents appelés respectivement résidu et condensat ou distillat. On réalise ainsi une étape élémentaire de séparation dont la répétition pourra permettre d'obtenir les constituants du mélange initial.
Bien que le premier traité à ce sujet, œuvre du chimiste français Arnaud de Villeneuve, ne soit paru qu'aux environs de 1311, l'« art de la distillation » daterait de plus de trois mille ans, et l'on pense que les Perses l'auraient découvert pour fabriquer l'eau de rose. Rappelons aussi qu'Aristote proposait aux marins de distiller l'eau de mer pour produire de l'eau douce.
Les premiers véritables appareils à distiller furent conçus par les coptes d'Alexandrie et les chrétiens d'Égypte ; ils comprenaient une cornue (cucurbite), un récipient de condensation des vapeurs (ambix) et un réceptacle des produits distillés (phiale). Le terme ambix a donné « alambic », qui désigne l'appareil entier de distillation.
Les médecins et pharmaciens améliorèrent les appareils et la technique. Ainsi, les apothicaires du xiie siècle surent préparer des médicaments alcoolisés dont l'usage se généralisa rapidement, Irlandais et Écossais se signalant alors par leur particulière compétence dans la préparation de ces boissons.
Les producteurs d'alcool furent d'ailleurs pendant longtemps les experts en distillation, et c'est grâce à leurs travaux, complétés principalement, depuis cinquante ans, par les recherches des ingénieurs de l'industrie pétrolière, que la distillation occupe une place industrielle aussi importante parmi les opérations de séparation. Pour la souligner, il faut rappeler que la distillation est l'opération de base du raffinage des pétroles bruts.
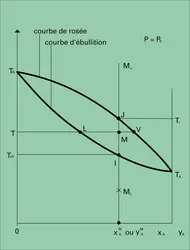
Équilibre liquide-vapeur d'un mélange binaire
Définitions
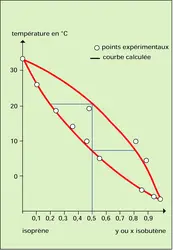
On exprimera ici la composition des mélanges en fractions moléculaires (rapport entre le nombre de molécules du constituant considéré et le nombre total correspondant de molécules du mélange). On les représentera par x pour les liquides et y pour les vapeurs. Un mélange binaire sera parfaitement défini par la connaissance de la fraction moléculaire en un seul constituant (xA par exemple), l'autre s'obtenant immédiatement par différence à l'unité (xB = 1 − xA).
La volatilité d'un constituant A d'un mélange s'exprime par le rapport de ses concentrations respectivement en phase vapeur et en phase liquide, c'est-à-dire KA = yA/xA
La distillation dépend finalement des différences de volatilité entre les constituants de la charge à séparer ; c'est afin de comparer les volatilités respectives que l'on a introduit la volatilité relative αAB définie par le rapport des volatilités :

Les volatilités dépendent à la fois de la pression et de la température auxquelles sont soumises la phase vapeur et la phase liquide en équilibre ainsi que des interactions s'exerçant entre les molécules de ces milieux.
On conçoit que plus αAB s'écartera de l'unité, plus aisée sera la séparation par distillation des corps A et B.
Si on veut préciser les définitions précédentes, on donne la composition des phases vapeur y et liquide x en équilibre à une température donnée et sous une certaine pression ainsi que les volatilités K et volatilités relatives α établies en choisissant convenablement un constituant de référence.
Considérons[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean DURANDET : Directeur de recherche à l'Institut français du pétrole (I.F.P.), ingénieur et professeur à l'Ecole nationale supérieure du pétrole et des moteurs (E.N.S.P.M.), chargé de cours à l'université catholique de Louvain
Classification
Médias
Autres références
-
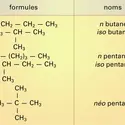
ALCANES
- Écrit par Jacques METZGER
- 3 616 mots
- 11 médias
...les alcanes, notamment linéaires, prédominent, et de molécules fonctionnelles en petit nombre. Soumis aux opérations de raffinage, ils sont séparés par distillation fractionnée en coupes contenant des mélanges dont les températures d'ébullition sont comprises dans un intervalle défini. Les termes les... -
ALCOOL ÉTHYLIQUE ou ÉTHANOL
- Écrit par Fernand COUSSEMANT
- 694 mots
Alcool primaire, liquide incolore, d'odeur agréable, miscible à l'eau en toutes proportions, miscible à de nombreux solvants organiques, l'éthanol ou alcool éthylique, CH3—CH2OH, a les caractéristiques suivantes :
Masse moléculaire : 46,07 g
Masse spécifique : 0,789 3...
-
AZÉOTROPE MÉLANGE
- Écrit par Pierre MOYEN
- 112 mots
Mélange présentant la propriété d'avoir une température d'ébullition unique et définie pour une composition déterminée ; un mélange azéotrope, ou un azéotrope, présente alors certaines propriétés physiques, qui sont celles des corps purs, et notamment la propriété d'avoir la même composition en phase...
-
CADMIUM
- Écrit par Alexandre TRICOT
- 8 051 mots
- 6 médias
Le cadmium recueilli au creuset de fusion à une température d'environ 450 0C est introduit dans un autre four à creuset de distillation dans lequel le métal est porté au-dessus de la température de vaporisation (770 0C). - Afficher les 12 références
Voir aussi
- PRESSION, physique
- LIQUIDE ÉTAT
- PLATEAU, génie chimique
- ÉTAGE, génie chimique
- VAPORISATION
- SÉPARATION, chimie
- COLONNE, génie chimique
- GAZEUX ÉTAT
- TEMPÉRATURE
- LIQUIDE-VAPEUR ÉQUILIBRE
- TENSION DE VAPEUR
- TEMPÉRATURE DU POINT DE ROSÉE
- VOLATILITÉ
- ALAMBIC
- CHIMIE HISTOIRE DE LA
- SOLUTION, chimie
- ÉBULLITION
- PHASES, physico-chimie
- DISTILLAT
- TEMPÉRATURE D'ÉBULLITION
- VAPEUR, chimie physique