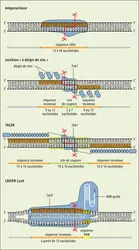
ÉDITION DES GÉNOMES
Article modifié le
Des applications à peine imaginables
Les usages de ces outils ne sont guère limités que par des considérations éthiques. Avec des systèmes aussi malléables, les organismes sur lesquels on applique ces techniques d’édition du génome sont très divers. La recherche dans ce domaine n’est pas dominée par la possibilité de modification transmissible du génome humain, actuellement au cœur d’un débat éthique fondamental. En revanche, la quasi-totalité des articles publiés porte sur la modification d’animaux modèles bien connus (souris, poisson-zèbre, Caenorhabditis elegans, etc.) ainsi que sur d’autres animaux (papillons, étoiles de mer, insectes, protozoaires parasites, grands mammifères) ou plantes. Les chercheurs en écologie s’y intéressent, puisqu’on n’est plus obligé de se limiter aux animaux modèles et que l’on peut manipuler les composants génétiques d’un écosystème. Dans la plupart des cas, on vise à créer un transgène, qui sera donc transmis à la descendance chez nombre d’animaux et de plantes. Les questions scientifiques posées sont également extrêmement diverses.
Les usages thérapeutiques sont très présents. L’édition du génome ouvre en effet de nombreuses possibilités d’intervention médicale. La plus évidente, déjà largement documentée, est la capacité de détruire des virus au sein d’une cellule infectée, VIH et virus de l’hépatite C pour la plupart des cas publiés. On a également déjà montré que l’on peut inactiver dans une cellule cancéreuse un ou plusieurs des gènes anormalement exprimés et responsables de l’état cancéreux ou des capacités métastatiques des cellules cancéreuses, limitant ainsi la prolifération tumorale.
Les applications thérapeutiques à plusieurs maladies génétiques chez l’homme sont au stade de l’essai clinique avec des résultats déjà remarquables. La guérison de deux anomalies génétiques de l’hémoglobine (l’anémie falciforme et la bêta-thalassémie), en rétablissant le fonctionnement de l’hémoglobine fœtale normale chez les malades – qui remplace l’hémoglobine adulte anormale –, a été annoncée en décembre 2020. L’intervention moléculaire a été réalisée sur les cellules souches sanguines de la moelle osseuse de malades.
Les perspectives thérapeutiques évoluent rapidement dans le sillage des avancées réalisées par la recherche ayant abouti à la mise au point de vaccins à ARN et ADN, particulièrement en ce qui concerne la stabilisation et la vectorisation de ces molécules, opérations nécessaires pour pouvoir les diriger vers des cellules et organes cibles. C’est ainsi qu’en 2021 des défauts génétiques affectant la vision ont pu être corrigés par injection directe dans l’œil du complexe CRISPR-Cas9 adéquat. En 2022, le champ des possibles s’est encore élargi en utilisant CRISPR-Cas9 adapté à la correction de l’amylose à transthyrétine (ATTR, qui provoque douleurs et œdèmes) en ciblant le gène de la kallicréine, une protéine qui joue un rôle important dans l’inflammation. CRISPR-Cas9 adapté à ce gène a été vectorisé dans des nanoparticules et ciblé pour les cellules hépatiques. Ces nanoparticules ont ensuite été simplement injectées dans le sang du patient, puis capturées par le foie où la kallicréine est produite. La correction attendue a été obtenue, car on observe un effondrement du taux de kallicréine et, de manière corollaire, la disparition des symptômes œdémateux. La stabilité de la correction dans le temps reste à évaluer. Cela posé, le fait de ne pas avoir besoin de passer par la manipulation de cellules souches est une révolution dans la faisabilité du traitement de nombreuses maladies génétiques ou virales.
Les projets d’applications biotechnologiques ne manquent pas. Ils concernent aussi bien les espèces animales que végétales. Les espèces ainsi modifiées sont dites NGT, pour [...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Gilles SAUCLIÈRES : journaliste scientifique
Classification
Médias
Voir aussi
- ENZYMES
- CAENORHABDITIS ELEGANS
- NUCLÉOTIDES
- RECOMBINAISON HOMOLOGUE, génétique moléculaire
- NUCLÉASES
- SCIENCES HISTOIRE DES, XXe XXIe s.
- SÉQUENÇAGE, génétique moléculaire
- THÉRAPIE CELLULAIRE
- PHYSIOLOGIE
- VARIABILITÉ GÉNÉTIQUE DES BACTÉRIES
- GÉNOME
- THÉRAPIE GÉNIQUE
- BIOLOGIE MOLÉCULAIRE
- MÉGANUCLÉASES
- CHROMOSOMES
- ENZYMES DE RESTRICTION ou ENDONUCLÉASES DE RESTRICTION
- GÉNÉTIQUE MOLÉCULAIRE
- LACTIQUES BACTÉRIES
- MOLÉCULES BIOLOGIQUES, structure et fonction
- PROTÉINES
- TRANSGENÈSE
- MUTAGENÈSE
- TRANSGÈNES
- CRISPR-Cas9