ÉLECTROPHORÈSE
Article modifié le
Électrophorèse de zone sur support
Si l'électrophorèse dite « libre », en veine liquide, permet une bonne détermination des mobilités électrophorétiques, elle présente par contre certains inconvénients : non seulement elle nécessite un appareillage coûteux, une mise en œuvre longue et délicate, mais encore elle ne permet pas de distinguer, d'isoler, ni de caractériser les fractions protéiques autrement que par leur mobilité.
C'est pourquoi, à partir de 1950, on a proposé différents supports qui permettent d'effectuer une électrophorèse de zone sur un support « stabilisateur » qui peut être le papier-filtre (E. Durrum, D. Cremer et A. Tiselius, W. Grassmann et K. Hannig, tous en 1950), l'acétate de cellulose (J. Kohn en 1957), ou encore le gel d'agar (C. A. Grabar et P. Williams en 1953, R. J. Wieme en 1959).
Ces supports ont connu un immense succès, car leur emploi est simple, rapide, peu onéreux. En outre, il ne nécessite que de très petites quantités de substances. Ainsi, dans le cas d'un sérum sanguin, quelques microlitres suffisent.
Quel que soit le support, on utilise une « cuve à électrophorèse » essentiellement constituée de deux bacs contenant le tampon et une électrode. Anode et cathode sont reliées à un générateur de courant continu. Les extrémités du support solide trempent dans le tampon ou lui sont reliées par des ponts en papier filtre.
Électrophorèse sur papier et sur acétate de cellulose
On dépose quelques microlitres de la solution à étudier (mélanges d'enzymes, de protéines sériques ou d'autres substances chargées) sous forme d'une ligne mince sur le support imbibé de tampon. On le soumet ensuite à une électrophorèse ; l'intensité du courant est voisine de 2 mA par centimètre de largeur du support.
Au bout de quelques heures, la feuille est séchée. Les différentes fractions sont révélées par des colorants spécifiques, qui permettent de caractériser, par exemple, les protéines, les glycoprotéines, les lipoprotéines. Quant aux enzymes, on peut les révéler en utilisant leur activité spécifique sur des substrats convenablement choisis.
Le pouvoir de résolution de cette technique n'est pas supérieur à celui de l'électrophorèse en veine liquide. Par exemple, à partir du sérum, on obtient six fractions : albumine , α1, α2, β1, β2 et γ-globulines.
L'interaction entre le support et les protéines n'est pas totalement négligeable, c'est là un inconvénient. Si elle est faible avec l'acétate de cellulose, elle est plus marquée avec le papier filtre. C'est pourquoi, dans les conditions normales, on ne peut déceler, avec ce support, dans le cas d'un sérum, les préalbumines, qui devraient migrer plus vite que l'albumine, mais qui sont freinées par leur adsorption par le papier. On y parvient cependant, par exemple, en augmentant la quantité de protéines déposée.
Électrophorèse en gel d'agar (gélose)
Le support est constitué à l'aide d'une solution de gélose (agar-agar) à 1 p. 100 dans le tampon choisi. On la coule à chaud sur une lame de verre où elle se solidifie par refroidissement. Le pouvoir de résolution est identique à celui du papier. Mais le gel d'agarose purifiée présente l'avantage de ne pas produire d'interaction avec les protéines.
Pour augmenter le nombre de fractions protéiques séparées par l'électrophorèse, on a proposé d'autres supports qui se comportent comme des tamis moléculaires. Il s'agit de gels poreux qui, par un phénomène de friction, retardent d'autant plus la migration des protéines que les dimensions de leurs molécules sont plus grandes. Ainsi le groupe des α2-globulines peut être résolu en une dizaine de constituants. On signalera les deux principaux procédés dans les paragraphes ci-dessous.
Électrophorèse en gel d'amidon
Elle a été proposée par Smithies en 1955. Elle utilise un amidon partiellement hydrolysé avec lequel on fait un gel contenant de 13 à 15 g d'amidon pour 100 ml de tampon. Le mélange, fluide à l'ébullition, est coulé dans un bac où il se prend en gel par refroidissement. On insère les protéines à séparer dans une fente pratiquée dans le gel. Après électrophorèse, on coupe le gel dans son épaisseur et on révèle les protéines par un des colorants habituels.
Avec un sérum humain, on peut obtenir près d'une vingtaine de bandes. L'opération complète demande au minimum quinze heures.
Électrophorèse en gel d'acrylamide
Elle a été décrite par S. Raymond et Weintraub en 1959, par B. J. Davis et L. Ornstein la même année. C'est une méthode très fine de séparation par simple électrophorèse sur support.
Une solution d'acrylamide, coulée dans de petits tubes verticaux, forme un gel par polymérisation. Les pores ont un diamètre de 5 nm environ. Les protéines à séparer sont déposées à une extrémité du gel dans lequel elles se déplacent sous l'action du champ électrique.
Après coloration, les protéines sont visibles sous forme de disques parallèles, superposés, d'où le nom de Disc-electrophoresis utilisé par les Anglo-Saxons.
Cette technique est rapide, précise, reproductible, sensible. Un sérum humain est résolu en au moins une vingtaine de fractions.
Le polyacrylamide ne donne aucune réaction avec les colorants, ni les protéines, ni les polysaccharides, ni les lipides. Le gel est transparent. Il permet une évaluation densitométrique plus aisée que celle obtenue lorsqu'on utilise le papier comme support.
Électrophorèses préparatives sur support
On a décrit plusieurs procédés qui permettent de séparer des groupes de protéines (albumine, α1, α2, β1, β2, γ-globulines) en vue de préparer ces fractions à partir, par exemple, d'un sérum. À cet effet, on utilise des portoirs de grandes dimensions dans lesquels on met une pâte d'amidon, ou de tout autre support neutre comme le Pévikon (chlorure de polyvinyle), ou même des gels (gélose, amidon, etc.). L'opération terminée, on découpe le support en tranches d'où l'on élue les protéines. Cette technique est évidemment utilisable pour préparer toute substance isolée par l'électrophorèse sur ce genre de support.
Électrophorèse à haute tension
L'emploi de tensions élevées – de l'ordre de 3 000 à 5 000 volts – permet de séparer, par électrophorèse à une ou deux dimensions perpendiculaires, des substances telles que peptides et acides aminés. On utilise une feuille de papier de 30 × 40 cm, placée entre deux plaques isolantes, refroidies à + 2 0C pour éviter que la feuille ne se dessèche et, finalement, ne se consume. L'appareillage nécessaire est assez onéreux. Un dispositif plus simple consiste à immerger la feuille à électrophorèse dans de l'éther de pétrole, lui-même refroidi par un serpentin.
La haute tension permet de séparer en une heure un mélange de substances comme les peptides obtenus par hydrolyse enzymatique d'une protéine. La « carte » obtenue par deux électrophorèses perpendiculaires avec deux tampons différents (ou une chromatographie dans une direction suivie d'une électrophorèse dans l'autre) constitue un diagramme caractéristique comme l'est une empreinte digitale, d'où le terme finger-print donné par les Anglo-Saxons à cette technique.
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean GUASTALLA : Directeur de Recherche honoraire au CNRS
- Jean MORETTI : maître de conférence à l'université de Montpellier
- Jean SALVINIEN : Professeur honoraire à la Faculté des Sciences de Montpellier.
Classification
Médias
Autres références
-
ÉLECTROPHORÈSE EN CHAMP PULSÉ
- Écrit par Jean-Luc GUESDON
- 263 mots
La technique d'électrophorèse classique en gel d'agarose ou de polyacrylamide permet de séparer des fragments d'ADN suivant leur taille. Sur ces gels constitués d'un réseau désorganisé de longues fibres, on dépose l'ADN dont les molécules sont chargées négativement. Soumises à...
-
ANALYTIQUE CHIMIE
- Écrit par Alain BERTHOD et Jérôme RANDON
- 8 890 mots
- 4 médias
Les espèces chargées, en solution, peuvent être séparées grâce à leurs différences de mobilité sous l'effet d'un champ électrique : en fonction de la charge et de la masse de la molécule, celle-ci se déplacera plus ou moins vite dans la solution. L'électrophorèse capillaire... -
GÉNÉTIQUE
- Écrit par Axel KAHN , Philippe L'HÉRITIER et Marguerite PICARD
- 25 881 mots
- 31 médias
...l'aide d'une enzyme de restriction, celui ou ceux contenant la séquence nucléotidique recherchée. Les fragments d'ADN sont séparés selon leur taille par électrophorèse, c'est-à-dire par migration dans un champ électrique au travers d'un gel jouant un rôle de tamis moléculaire. Une autre technique, consistant... -
HÉMOGLOBINOPATHIES
- Écrit par Michel COHEN-SOLAL et Jean-Claude DREYFUS
- 3 854 mots
- 6 médias
Laséparation des hémoglobines est habituellement fondée sur les propriétés de la charge électrique de la globine. Celle-ci, comme toutes les protéines, est un ampholyte ; les fonctions acides et bases libres portées par les acides aminés de la protéine sont plus ou moins ionisées selon le pH du milieu.... -
IMMUNOCHIMIE
- Écrit par Joseph ALOUF
- 9 360 mots
- 6 médias
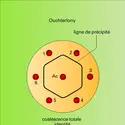
Dans un gel aqueux transparent, on fait migrer parélectrophorèse les constituants du liquide à examiner. On fait ensuite diffuser perpendiculairement à l'axe de migration un immunsérum contenant des anticorps précipitant les constituants (antigènes) du mélange. Lorsque ces anticorps rencontrent les... - Afficher les 14 références
Voir aussi