ÉNERGIE La notion
Chaleur et thermodynamique
Énergie interne
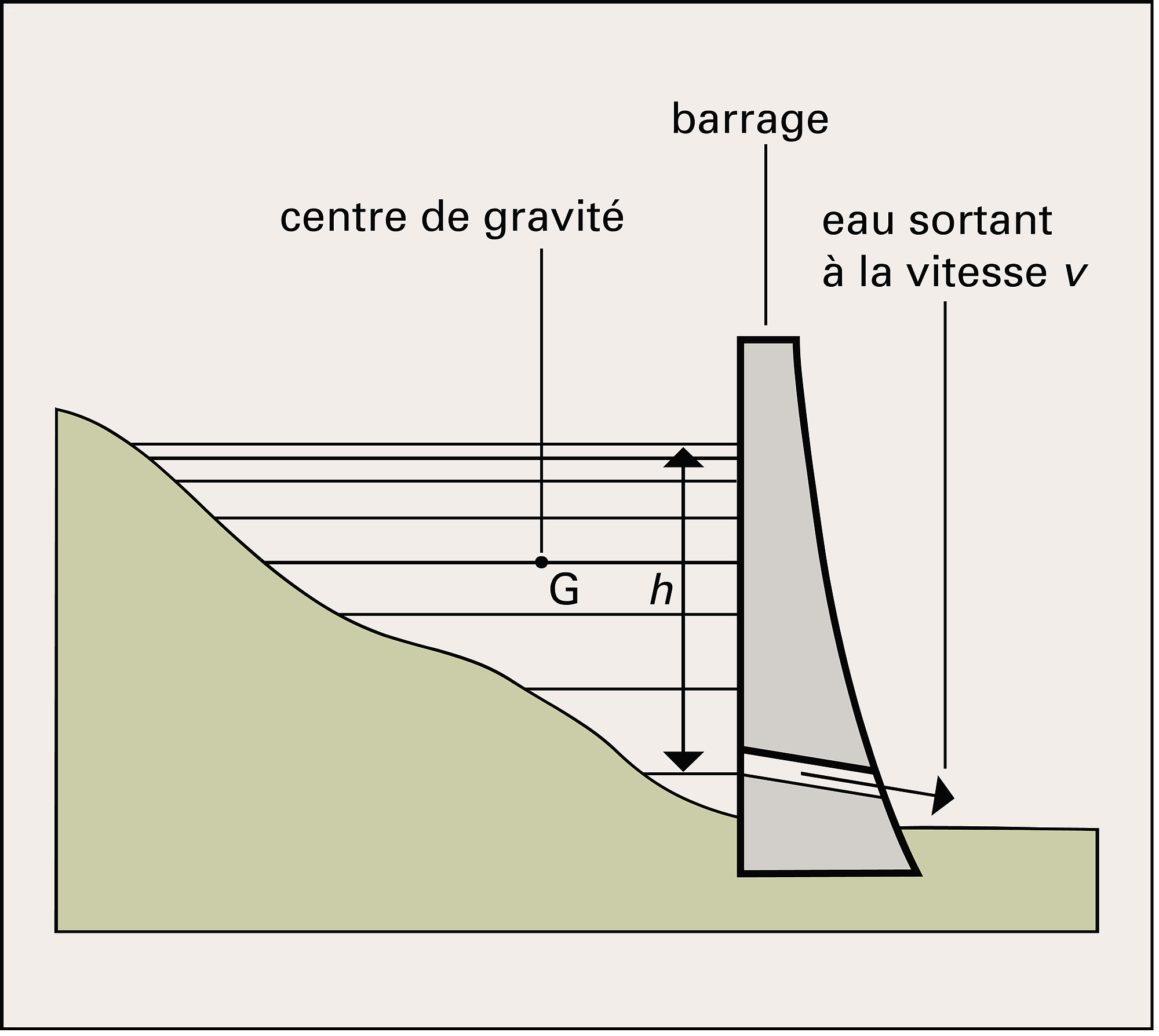
La thermodynamique s'intéresse aux échanges d'énergie entre systèmes macroscopiques. À l'échelle atomique, ces systèmes sont composés de particules (molécules) douées d'énergie cinétique, et aussi d'énergie potentielle mutuelle représentant l'interaction de ces particules entre elles. On appelle énergie interne cette énergie associée à la mécanique interne du système à l'échelle microscopique. La description détaillée d'un état du système met en jeu un grand nombre des variables (positions de toutes les molécules ; leurs vitesses ; leurs orientations, etc.). Cependant, à l'échelle moins fine qui est la nôtre, les propriétés du système sont suffisamment bien décrites par un petit nombre de variables, dites macroscopiques (le volume, la masse, la pression, la température, l'indice de réfraction, etc.). L'énergie interne d'un système à l'équilibre apparaît alors comme une fonction des variables macroscopiques d'état.
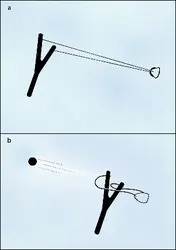
Travail
Le travail est de l'énergie échangée par un système avec l'extérieur sous forme ordonnée. C'est-à-dire que les particules sont toutes poussées dans un même sens sous l'influence de forces extérieures : électrons sous l'influence d'un champ électrique, molécules sous la poussée d'un piston, etc. Ce travail peut être de diverse nature. Il peut s'agir, par exemple, d'un travail électrique : le système est traversé par un courant électrique qui entre par une borne et sort par une autre. Un générateur extérieur fait régner entre ces bornes une différence de potentiel électrique U et débite un courant d'intensité I. Le travail reçu par le système pendant un temps dt est alors dW = UI dt. Un cas fréquent pour les fluides est le travail des forces de pression. Un fluide occupant un volume V est soumis à une pression extérieure p0, si le volume varie de dV, le travail reçu par le système est dW = — p0dV. Si la pression interne p est égale à p0, le système est pratiquement à l'équilibre et la transformation est dite réversible ; le travail reçu est alors — pdV.
Chaleur
Un transfert d'énergie se fait sous forme de chaleur lorsque les molécules du système interagissent de façon désordonnée avec le milieu extérieur. Ainsi, lorsqu'on place deux corps, l'un chaud et l'autre froid, en contact, les molécules du corps chaud, dont l'énergie cinétique d'agitation est plus grande, frappent les molécules du corps froid et leur communiquent une partie de leur énergie, égalisant ainsi les températures. La manière la plus usuelle de fournir de la chaleur à un système est donc d'élever sa température. Mais ce n'est pas la seule. Il faut, par exemple, fournir de la chaleur pour faire bouillir de l'eau ; tant que dure l'ébullition, la température reste constante (100 0C). La quantité de chaleur communiquée sert à augmenter l'énergie potentielle d'interaction mutuelle des molécules d'eau jusqu'à ce qu'elles se séparent et forment de la vapeur.
Les transformations du travail en chaleur et de la chaleur en travail sont régies par les lois de la thermodynamique.
Les principes de la thermodynamique
Le premier principe, ou principe de l'équivalence, énonce l'équivalence du travail et de la chaleur. Dans une transformation fermée, où le système revient à un état macroscopique identique à celui dont il est parti, l'énergie interne n'a pas varié. Si le système a reçu du travail, il a cédé de la chaleur et, s'il a reçu de la chaleur, il a cédé du travail. Dans une transformation quelconque, on peut écrire ΔU = W + Q, où, en valeurs algébriques, W est le travail reçu, et Q la chaleur reçue.
Ce principe énonce que le travail[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Julien BOK : ancien directeur du laboratoire de physique de l'École normale supérieure
Classification
Médias
Autres références
-
ACCÉLÉRATEURS DE PARTICULES
- Écrit par Michel CROZON et Jean-Louis LACLARE
- 3 528 mots
- 3 médias
...atomiques. Très vite, on éprouva le besoin de changer les paramètres des expériences, donc de disposer de faisceaux plus intenses, mieux focalisés, et surtout réglables en énergie. L'unité élémentaire de mesure pour cette dernière est l'électronvolt (1 eV = 1,602 × 10—19 J), ainsi... -
PARTICULES ÉLÉMENTAIRES
- Écrit par Maurice JACOB et Bernard PIRE
- 8 172 mots
- 12 médias
...(charge, saveur, couleur) opposées. Au niveau des interactions connues, il y a conservation du nombre global de quarks diminué du nombre d'antiquarks. La transformation de l'énergie en matière ou de la matière en énergie correspond à la production ou à l' annihilation de paires particule-antiparticule.... -
ANTIMATIÈRE
- Écrit par Bernard PIRE et Jean-Marc RICHARD
- 6 931 mots
- 4 médias
Les premières descriptions du mouvement des particules élémentaires furent fondées sur l'équation de Klein-Gordon. En résolvant cette dernière, on obtient les états d'énergie E :
-
ARCHITECTURE ÉCOLOGIQUE ou ARCHITECTURE DURABLE
- Écrit par Dominique GAUZIN-MÜLLER
- 5 070 mots
- 1 média
- Afficher les 59 références