- 1. Vitesse de réaction et activité catalytique spécifique des enzymes
- 2. Notion de cycle catalytique
- 3. Loi de vitesse d’une réaction catalysée par une enzyme
- 4. Détermination expérimentale d’une loi de vitesse
- 5. La loi de vitesse de Michaelis-Menten
- 6. Cinétique des réactions enzymatiques transformant plusieurs substrats
- 7. Inhibition
ENZYMES Cinétique enzymatique
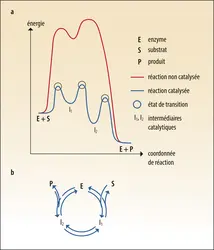
Notion de cycle catalytique
Toute activité catalytique est liée à l’abaissement de l’énergie d’activation de la réaction catalysée. De ce fait, on présente souvent une réaction chimique à l'aide d'un profil qui représente l'énergie libre du système en fonction d'une coordonnée de réaction et schématise l'évolution du processus chimique. Lorsque l'énergie libre du système enzyme + réactifs est plus élevée que celle du système enzyme + produits, les principes de la thermodynamique chimique imposent que la réaction avance vers la formation des produits ; la vitesse de cette réaction dépend cependant du mécanisme réactionnel et de la nature du catalyseur. En particulier, il faut que l’interaction entre les réactifs et le catalyseur produise un état de transition. En l’absence de catalyseur, cet état de transition a une énergie élevée et se produit rarement. Les interactions entre l’enzyme et les réactifs sont telles que le profil énergétique de l’ensemble enzyme + réactifs est « en montagne russe ». Les « sommets » sont des états de transition de faible énergie, les « vallées » des intermédiaires réactionnels. La succession des étapes constitue le cycle catalytique de l’enzyme. Comme tout catalyseur, l’enzyme n'est pas consommée pendant la réaction : elle est modifiée de façon réversible au cours du cycle, et retrouve son état initial à la fin de la réaction. L’étude du mécanisme de l’enzyme doit permettre d’identifier la nature des intermédiaires réactionnels, et de comprendre comment l’interaction avec l’enzyme abaisse l’énergie des états de transition.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Christophe LÉGER : directeur de recherche au CNRS, Laboratoire de bioénergétique et ingénierie des protéines, Marseille
Classification
Médias