- 1. Vitesse de réaction et activité catalytique spécifique des enzymes
- 2. Notion de cycle catalytique
- 3. Loi de vitesse d’une réaction catalysée par une enzyme
- 4. Détermination expérimentale d’une loi de vitesse
- 5. La loi de vitesse de Michaelis-Menten
- 6. Cinétique des réactions enzymatiques transformant plusieurs substrats
- 7. Inhibition
ENZYMES Cinétique enzymatique
Loi de vitesse d’une réaction catalysée par une enzyme
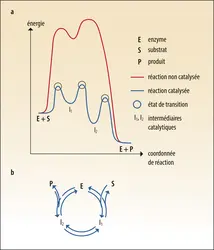
La loi de vitesse d'une réaction chimique est l'équation qui relie la vitesse de la réaction aux concentrations en réactifs et à des constantes de vitesse. Il arrive fréquemment que la vitesse suive ce qu'on appelle en mathématiques une loi de puissance : la vitesse est alors proportionnelle aux concentrations en réactifs, élevées à une certaine puissance. Par exemple, pour une réaction qui transforme de façon irréversible deux réactifs A et B en un produit C, la vitesse de réaction peut être proportionnelle au produit des concentrations des réactifs, affectées chacune d’un exposant : v = k[A]α[B]β, où α et β sont les ordres partiels par rapport à A et B, et la somme α + β est l'ordre total de la réaction. On parle de réaction unimoléculaire ou bimoléculaire quand l'ordre total est égal à 1 ou 2, respectivement. On ne peut pas déduire directement la loi de vitesse de la stœchiométrie de l'équation bilan de la réaction : elle doit être déterminée expérimentalement et elle donne une information sur le mécanisme. Par exemple, les réactions de substitution nucléophile en chimie organique (dans laquelle un groupe riche en électrons attaque un atome pauvre en électrons) peuvent être bimoléculaires ou unimoléculaires, selon que la réaction se déroule en une seule étape ou bien en deux étapes (avec la formation unimoléculaire et lente d'un intermédiaire carbocation stable, puis l'attaque nucléophile bimoléculaire) ; c'est l'examen de la loi de vitesse qui donne l'information sur le mécanisme opérationnel dans chaque cas particulier.
Une loi de vitesse simple (unimoléculaire ou bimoléculaire) est observée soit quand la réaction est élémentaire (c’est-à-dire si les réactifs réagissent simultanément en un même point pour donner directement les produits, sans former d'espèces intermédiaires), soit quand elle consiste en une série d'étapes élémentaires irréversibles dont l'une est plus lente que toutes les autres et détermine la vitesse de la réaction. Mais, dans le cas général d'un mécanisme catalytique qui enchaîne des étapes unimoléculaires et bimoléculaires, dont certaines peuvent être réversibles, la loi de vitesse peut être plus complexe qu’une loi de puissance.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Christophe LÉGER : directeur de recherche au CNRS, Laboratoire de bioénergétique et ingénierie des protéines, Marseille
Classification
Médias