- 1. Vitesse de réaction et activité catalytique spécifique des enzymes
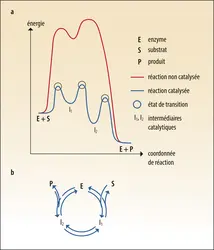
- 2. Notion de cycle catalytique
- 3. Loi de vitesse d’une réaction catalysée par une enzyme
- 4. Détermination expérimentale d’une loi de vitesse
- 5. La loi de vitesse de Michaelis-Menten
- 6. Cinétique des réactions enzymatiques transformant plusieurs substrats
- 7. Inhibition
ENZYMES Cinétique enzymatique
Détermination expérimentale d’une loi de vitesse
Les chimistes et les biochimistes utilisent des approches différentes pour déterminer expérimentalement la loi de vitesse. Les chimistes comparent souvent la façon dont la concentration en réactif varie au cours du temps avec la version « intégrée » de la loi de vitesse : par exemple, si la cinétique de transformation irréversible d'un réactif A suit une loi de vitesse du premier ordre avec une constante de vitesse d'ordre un (k), on peut intégrer cette loi de vitesse pour en déduire que la concentration en A, initialement égale à [A]0, devrait diminuer exponentiellement en fonction du temps : [A]=[A]0·exp(–kt). Observer expérimentalement que la concentration en A décroît exponentiellement (par exemple constater que la variation de log[A] en fonction du temps est une droite) prouve que la cinétique est unimoléculaire. Cette méthode dite intégrale peut être utilisée quand la loi de vitesse est simple.
Les lois de vitesse observées pour les réactions catalysées par des enzymes sont plus complexes que des lois de puissance, et les biochimistes ont renoncé à utiliser la méthode intégrale. Ils ont privilégié depuis le début du xxe siècle laméthode ditedifférentielle, qui consiste à s'intéresser non pas à la variation de concentration en réactif pendant toute l'expérience, mais simplement à la vitesse mesurée en tout début d'expérience (vi pour vitesse initiale), et à répéter l'expérience avec différentes concentrations en substrat pour finalement examiner comment la vitesse initiale dépend de la concentration initiale en substrat. Ces vitesses sont dites initiales et stationnaires. L’adjectif « initial » implique que la mesure est réalisée assez tôt après le début de la réaction pour que les concentrations des réactifs n'aient pas eu le temps de diminuer significativement, et que les concentrations des produits soient restées négligeables. Le terme « stationnaire » signifie que la vitesse est indépendante du temps ; cela implique que la concentration en substrat diminue linéairement avec le temps, ce qui n'est possible qu’en début d'expérience. Ces deux propriétés simplifient beaucoup les calculs des lois de vitesse, dont voici trois exemples expérimentaux classiques :
– La loi de vitesse est conforme à l’équation de Michaelis-Menten (voir infra), ce qui constitue un cas courant : la valeur de vi augmente proportionnellement à la concentration en substrat (elle est d'ordre partiel 1 par rapport au substrat) quand celle-ci est petite ; elle tend vers un plateau (ordre partiel 0 par rapport au substrat) à haute concentration en substrat (saturation).
– La valeur de vi augmente de manière sigmoïdale avec la concentration en substrat. Ce type de situation est observé, entre autres, avec l’aspartate transcarbamoylase(une enzyme de la voie de synthèse des bases pyrimidiques).
– La valeur de vi diminue à haute concentration en substrat (on parle d'inhibition par le substrat).
Ces trois exemples de lois de vitesse reflètent des mécanismes catalytiques différents.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Christophe LÉGER : directeur de recherche au CNRS, Laboratoire de bioénergétique et ingénierie des protéines, Marseille
Classification
Médias