- 1. Vitesse de réaction et activité catalytique spécifique des enzymes
- 2. Notion de cycle catalytique
- 3. Loi de vitesse d’une réaction catalysée par une enzyme
- 4. Détermination expérimentale d’une loi de vitesse
- 5. La loi de vitesse de Michaelis-Menten
- 6. Cinétique des réactions enzymatiques transformant plusieurs substrats
- 7. Inhibition
ENZYMES Cinétique enzymatique
La loi de vitesse de Michaelis-Menten
En cinétique (qu’elle soit chimique ou enzymatique), il s’agit donc de déterminer expérimentalement la loi de vitesse et d'en déduire un mécanisme catalytique. Concrètement, on procède par essai et erreur pour identifier un mécanisme qui permet de prédire une loi de vitesse en accord avec le résultat expérimental. On déduit une loi de vitesse théorique d'une hypothèse de mécanisme, et on la compare à des données expérimentales. Observer qu'une loi de vitesse particulière ne rend pas compte des données expérimentales conduit à réfuter le modèle. Mais observer qu'une loi de vitesse particulière rend compte des données expérimentales ne suffit pas à confirmer les hypothèses du modèle, parce que plusieurs modèles peuvent donner la même loi de vitesse.
La loi de vitesse la plus célèbre en cinétique enzymatique – au demeurant la plus fréquemment observée – est celle que l'on attribue à l'Allemand Leonor Michaelis (1845-1949) et à la Canadienne Maud Menten (1879-1960) en 1913, bien qu’elle ait été écrite sous une forme voisine par le Français Victor Henri (1872-1940) dès 1902. Dans le cas d'une enzyme qui consomme irréversiblement un substrat unique, appelé S, cette équation relie la vitesse initiale de la réaction, vi, à la concentration initiale en substrat, [S]0, et dépend de deux paramètres vmax et KM (dont les significations sont discutées plus bas) :
.
Cette équation prévoit que la vitesse initiale de la réaction tend vers 0 quand la concentration initiale en substrat tend vers 0, et tend asymptotiquement vers une limite vmax quand la concentration en substrat tend vers l'infini.
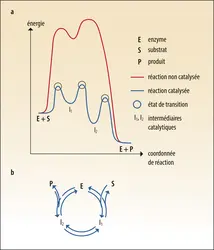
De multiples justifications de l'équation de Michaelis-Menten ont été proposées au début du xxe siècle. La plus courante s'appuie sur une hypothèse de mécanisme formulée par George E. Briggs (1893-1985) et John B. S. Haldane (1892-1964) en 1925. Dans cette hypothèse, l’enzyme sous sa forme « libre » (E) se lie au substrat au cours d’une étape bimoléculaire (constante de vitesse d'ordre 2, k1) pour former un complexe enzyme- substrat (ES). Celui-ci peut se dissocier avec une constante de vitesse d'ordre 1, k–1, ou réagir et libérer le produit de la réaction P et l’enzyme libre avec une constante de vitesse d'ordre 1, k2.
La constante d'équilibre de dissociation du complexe ES est Kd = k–1/k1, mais le système est déplacé de l'équilibre par la réaction catalytique. Le développement mathématique utilise les hypothèses que la concentration en S est constante et égale à la concentration initiale et que la vitesse de la réaction est stationnaire pour calculer la vitesse initiale vi. En posant vmax = k2[E]totet KM = (k2 + k–1)/k1, on obtient bien l’équation de Michaelis-Menten.
Même dans le cas de mécanismes enzymatiques plus complexes que celui considéré ici, les hypothèses faites ci-dessus – les concentrations gardent leur valeurs initiales et la vitesse est stationnaire – réduisent le calcul de la loi de vitesse à la simple résolution d'un système d'équations linéaires.
Détermination, signification et valeurs typiques des paramètres de la loi de Michaelis-Menten
Les valeurs des paramètres vmax et KM de l’équation de Michaelis-Menten sont caractéristiques d’un « couple » enzyme-substrat donné, mais dépendent aussi des conditions expérimentales (pH, température, etc.).
Comment mesurer vmax et KM ?
Il existe deux types de méthodes pour examiner si les vitesses initiales mesurées varient bien comme prévu par l’équation de Michaelis-Menten, tout en déterminant les deux paramètres vmax et KM.
La première est un traitement graphique simple qui consiste à tracer non pas vi en fonction de [S]0, mais 1/vi en fonction de 1/[S]0. En partant de l’équation de Michaelis et Menten[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Christophe LÉGER : directeur de recherche au CNRS, Laboratoire de bioénergétique et ingénierie des protéines, Marseille
Classification
Médias