- 1. Vitesse de réaction et activité catalytique spécifique des enzymes
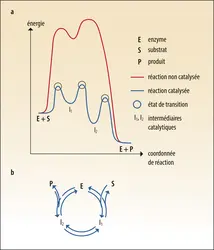
- 2. Notion de cycle catalytique
- 3. Loi de vitesse d’une réaction catalysée par une enzyme
- 4. Détermination expérimentale d’une loi de vitesse
- 5. La loi de vitesse de Michaelis-Menten
- 6. Cinétique des réactions enzymatiques transformant plusieurs substrats
- 7. Inhibition
ENZYMES Cinétique enzymatique
Cinétique des réactions enzymatiques transformant plusieurs substrats
La plupart des enzymes catalysent une réaction où interviennent plusieurs substrats. La loi de vitesse dépend de la séquence d'événements dans le cycle catalytique et en particulier de l'ordre dans lequel les substrats se lient à l'enzyme et les produits sont relargués. Dans la plupart des cas, dans des expériences où l'on fait varier la concentration d'un seul des substrats, la vitesse initiale suit une loi de Michaelis-Menten en fonction de la concentration de ce substrat, avec des paramètres vmaxet KM dont les valeurs dépendent de la concentration de l'autre substrat. Examiner cette dépendance permet de déterminer quel mécanisme est opérationnel.
Pour une réaction à deux substrats, on peut ainsi distinguer entre le mécanisme qui fait intervenir comme intermédiaire un complexe ternaire,dans lequel sont associés l'enzyme et ses deux substrats, et un autre mécanisme, appelé « ping-pong », dans lequel un premier substrat est transformé, ce qui produit une forme modifiée de l'enzyme, puis le deuxième substrat est transformé et la forme initiale de l'enzyme est régénérée.
La dihydrofolate réductase, qui catalyse la réduction de l’acide dihydrofolique (DHF) par le nicotinamide adénine dinucléotide phosphate sous une forme réduite (NADPH) est un exemple d’enzyme à deux substrats (DHF et NADPH). Le mécanisme fait intervenir un complexe ternaire, dans lequel le DHF et le NADPH sont idéalement positionnés pour permettre un transfert direct d’hydrure de l’un à l’autre.
Les enzymes de la famille des protéases à sérine, qui catalysent la coupure par hydrolyse de liaisons peptidiques, sont un exemple d’enzyme utilisant un mécanisme de type ping-pong : l’enzyme s’associe au premier substrat, le peptide à cliver, et un premier produit de la réaction est libéré avant que le deuxième substrat, l’eau, n’entre dans le site actif de l’enzyme. Certaines enzymes qui catalysent des réactions de transferts d’électrons (oxydoréductases) fonctionnent aussi selon un mécanisme ping-pong, l’enzyme étant alternativement oxydée par un de ses substrats et réduite par l’autre.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Christophe LÉGER : directeur de recherche au CNRS, Laboratoire de bioénergétique et ingénierie des protéines, Marseille
Classification
Médias