- 1. Vitesse de réaction et activité catalytique spécifique des enzymes
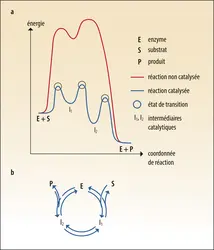
- 2. Notion de cycle catalytique
- 3. Loi de vitesse d’une réaction catalysée par une enzyme
- 4. Détermination expérimentale d’une loi de vitesse
- 5. La loi de vitesse de Michaelis-Menten
- 6. Cinétique des réactions enzymatiques transformant plusieurs substrats
- 7. Inhibition
ENZYMES Cinétique enzymatique
Inhibition
Un inhibiteur est une molécule qui se lie à l'enzyme et en diminue l'activité. On peut s’intéresser à cette réaction d'inhibition pour plusieurs raisons : on peut vouloir comprendre, par exemple, des mécanismes de régulation qui se produisent in vivo, ou bien produire des médicaments dont le mécanisme d'action est de ralentir certaines réactions catalysées par des enzymes particulières. L'étude de l'inhibition peut aussi informer sur le mécanisme catalytique.
On considère ici seulement les cas où le complexe formé par association de l'enzyme et de l'inhibiteur n'a pas du tout d'activité catalytique – on parle d'inhibition complète, linéaire, ou simple –, et le complexe est formé de façon réversible. On peut montrer que, si l'enzyme obéit à une loi de vitesse michaelienne en l'absence d'inhibiteur, alors en présence d'un inhibiteur réversible la loi de vitesse de Michaelis-Menten reste valide, mais les paramètres vmaxet KM prennent des valeurs qui dépendent de la concentration en inhibiteur, [I]. C'est en examinant cette dépendance que l'on peut identifier le mécanisme d'inhibition : il s’agit de la même stratégie expérimentale que celle qui permet d'identifier les mécanismes catalytiques d'enzymes transformant plusieurs substrats. On distingue trois mécanismes d'inhibition : compétitif, incompétitif, et non compétitif.
Un inhibiteur compétitif est une molécule qui ressemble suffisamment au substrat pour pouvoir prendre sa place dans le site actif de l'enzyme, mais qui n'est pas transformée par l'enzyme. La formation du complexe enzyme-inhibiteur est en compétition avec la formation du complexe enzyme-substrat, et l'effet de l'inhibiteur peut donc être compensé par une augmentation de la concentration en substrat : la présence de l'inhibiteur augmente la valeur de KM, mais ne change pas la valeur de la vitesse maximale (à concentration en substrat infinie, la réaction d'association est nécessairement entièrement déplacée vers la formation du complexe enzyme-substrat).
Le complexe enzyme-inhibiteur n'ayant aucune activité catalytique, il est plus stable et plus facile à isoler et caractériser que le complexe enzyme-substrat, et la connaissance de sa structure est très utile parce qu'elle informe sur la façon dont le substrat se fixe dans le site actif. C'est une des raisons pour lesquelles l'étude d'inhibiteurs compétitifs peut donner des informations sur le mécanisme de catalyse. Par exemple, l’enzyme CO déshydrogénase, qui catalyse l’oxydation du CO en CO2, a été cristallisée dans un état où le cyanure est fixé sur le site actif ; le cyanure est un analogue du monoxyde de carbone et inhibe la réaction de façon compétitive. La structure de l’enzyme inhibée par le cyanure indique donc comment le CO se fixe sur le site actif avant d’être oxydé.
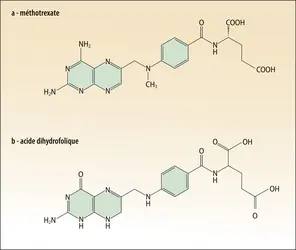
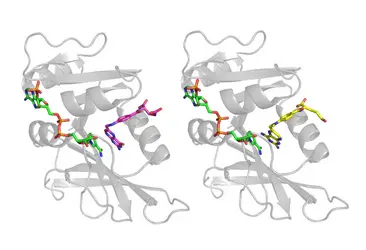
Les inhibiteurs compétitifs peuvent être des médicaments quand ils ciblent une enzyme dont on veut diminuer l'activité. Par exemple, la structure du méthotrexate est très proche de celle de l’acide dihydrofolique, et c'est en effet un inhibiteur compétitif de l'enzyme dihydrofolate réductase : le méthotrexate se lie à l’enzyme exactement dans la même position que le substrat. La dihydrofolate réductase a pour fonction de réduire l'acide dihydrofolique dans une étape essentielle de la synthèse de la thymidine, et donc de l'ADN. L'inhibition de la dihydrofolate réductase permet de limiter la croissance cellulaire et, pour cette raison, le méthotrexate est utilisé comme médicament anticancéreux.
Un inhibiteur incompétitifempêche l'enzyme de fonctionner en se fixant sur le complexe enzyme-substrat. La présence de ce type d'inhibiteur diminue d'un même facteur les valeurs[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Christophe LÉGER : directeur de recherche au CNRS, Laboratoire de bioénergétique et ingénierie des protéines, Marseille
Classification
Médias