ENZYMES Cofacteurs de l'activité enzymatique
Importance du noyau tétrapyrrole
Cette participation à des mécanismes réactionnels est aussi une caractéristique de certains cofacteurs, molécules organiques fixées de manière stable à la protéine, appelées alors groupements prosthétiques : l'enzyme dépourvue du coenzyme est appelée apoenzyme et est souvent dénaturée (perte du repliement fonctionnel) par opposition à l'enzyme active dite holoenzyme.
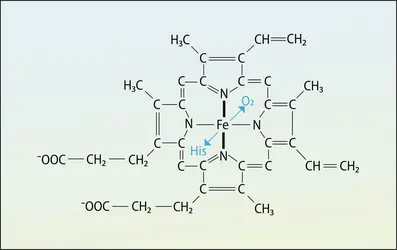
Parmi ces groupements prosthétiques, une famille de molécules, qui possèdent en commun un noyau tétrapyrrole, joue un rôle essentiel dans tous les organismes eucaryotes. C'est le cas des noyaux tétrapyrroles fixant le fer, retrouvés dans les hémoglobines des vertébrés, ou le magnésium dans la chlorophylle (essentiel à la photosynthèse) dans les chloroplastes, ou encore le cuivre chez des invertébrés ; tous jouent un rôle crucial dans les échanges gazeux impliquant l'oxygène et le gaz carbonique. C'est aussi le cas de la cobalamine, une structure également tétrapyrrolique qui contient du cobalt, et est essentielle au métabolisme des groupes méthyle et dans la synthèse des protéines : ce n'est autre qu'un dérivé de la vitamine B12. On peut tenir les groupements prosthétiques comme des sortes de cages organiques qui stabilisent l'atome métallique dans une position et une coordinance lui permettant de jouer son rôle fonctionnel.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Encyclopædia Universalis : services rédactionnels de l'Encyclopædia Universalis
Classification
Médias