ÉPIGÉNÉTIQUE
Article modifié le
Rôles in vivo des mécanismes épigénétiques
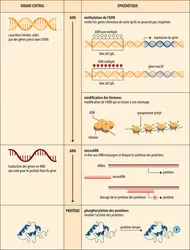
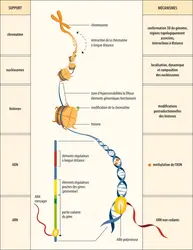
Il est important de retenir que la méthylation de l’ADN, les modifications des histones et les ARN non codants sont étroitement associés au plan fonctionnel in vivo, chacun pouvant influer ou modifier une ou les deux autres marques. Les quelques exemples suivants illustrent l’importance et la diversité des phénomènes épigénétiques dans des domaines très variés de la biologie.
Empreinte parentale
Le génome humain, diploïde, contient deux copies de chaque gène, les allèles : l’une est portée par le chromosome apporté par le père, et l’autre par le chromosome d’origine maternelle. Dans la plupart des cas, les deux allèles s’expriment de manière équivalente dans la cellule. Toutefois, une centaine de gènes échappent à cette règle et sont exprimés spécifiquement par l’un ou l’autre des deux allèles. On dit que ces gènes sont soumis à l’empreinte parentale. L’empreinte est un phénomène épigénétique car il repose sur la méthylation de l’ADN, les modifications des histones et les ARN non codants chez l’un des parents et intègre nécessairement la notion de transmission sur au moins une génération. Chez les animaux, l’empreinte parentale est apparue tardivement au cours de l’évolution : elle n’existe que chez les marsupiaux et les mammifères placentaires. Plusieurs gènes soumis à l’empreinte parentale agissent lors du développement embryonnaire, pendant lequel ils régulent la croissance du placenta ou celle de l’embryon lui-même. Il a été par exemple montré que des défauts d’expression du locus soumis à empreinte appelé H19/IGF2 conduit à des défauts de croissance chez la souris. Les expériences visant à créer des embryons de souris avec deux génomes paternels (androgenèse) ou deux génomes maternels (parthénogenèse) montrent que ceux-ci ne peuvent se développer normalement au-delà de quelques jours.
L’inactivation d’un chromosome X
Chez les mammifères, la femelle possède deux chromosomes X, mais seulement un seul est actif. Le deuxième est inactivé de manière épigénétique. Cette inactivation d’un chromosome entier a été le premier phénomène épigénétique d’importance identifié au début des années 1970 par la généticienne britannique Mary F. Lyon. Cette inactivation est assurée notamment par le long ARN non codant Xist. L’égalité dans l’expression des gènes portés par les chromosomes X entre les mâles, qui n’ont qu’un chromosome X, et les femelles, qui en ont deux, est rétablie par cette inactivation. Ce phénomène est par exemple responsable du pelage bicolore des chattes « écaille de tortue », dont l’un des gènes impliqués dans la couleur du pelage est porté par le chromosome X. La couleur de l’animal dépendra de l’allèle de ce gène exprimé par le X qui a échappé à l’inactivation. Contrairement à l’empreinte parentale, l’inactivation est un processus aléatoire touchant indifféremment le chromosome X d’origine paternelle ou maternelle dans chaque cellule. Des mécanismes de compensation de dose (« des chromosomes sexuels ») similaires ou combinant méthylation de l’ADN et marques d’histones ont été mis en évidence dans le dimorphisme sexuel chez d’autres espèces (drosophile, oiseaux, sauropsidés « reptiles »).
Épigénétique et atteintes du système nerveux chez l’homme
La délétion de la région 15q11-q13 du bras long d’un chromosome 15, l’autre chromosome étant normal, provoque des maladies mentales chez l’enfant. En effet, cette région est soumise à l’empreinte parentale. Si le chromosome tronqué est d’origine maternelle, les enfants développeront un syndrome d’Angelman, un retard sévère du développement mental associé à des troubles neurologiques divers. En revanche, si cette même délétion est portée par le chromosome d’origine paternelle et est combinée à une méthylation de la région équivalente sur le chromosome maternel, les enfants développeront le syndrome de Prader-Willi, caractérisé par des troubles alimentaires et une obésité morbide. Des mutations dans une ADN méthyltransférase (appelée DNMT3A) ou dans une protéine capable d’interagir avec l’ADN méthylé (appelée MECP2) sont la cause des syndromes d’immunodéficience combinée et de Rett, un polyhandicap psychomoteur. Les phénotypes de ces syndromes sont la conséquence d’un remodelage plus ou moins important de l’épigénome des cellules des sujets, causé par les mutations de ces gènes.
Par ailleurs, il existe un nombre croissant de publications liant modifications épigénétiques et divers troubles neurologiques, et la médecine se pose alors la question de savoir s’il s’agit d’une simple corrélation ou d’une relation de causalité entre les deux.
Épigénétique et cancers
Le cancer peut être dû à une anomalie de la séquence de l’ADN lorsque certains gènes impliqués dans la division cellulaire et son contrôle sont touchés par une mutation, une délétion ou une translocation chromosomique. Mais les anomalies épigénétiques intervenant sur un ADN apparemment normal sont au moins aussi importantes en cancérogenèse. Les études réalisées à l’échelle du génome entier montrent que les patrons de méthylation de l’ADN sont profondément remaniés dans les cellules tumorales. On observe par exemple une hyperméthylation des îlots de CpG au niveau des promoteurs des gènes suppresseurs de tumeurs (GST), ce qui bloque leur activité et la fonction de la protéine pour laquelle chacun code. Causes et (ou) conséquences de l’évolution d’un cancer, ces altérations constituent des biomarqueurs intéressants qui permettent de distinguer une cellule normale d’une cellule tumorale, indépendamment de la séquence de son génome. L’épigénome est intimement lié à la notion d’identité cellulaire (type cellulaire), ici l’identité tumorale. Des mutations ont été identifiées parmi les enzymes de remodelage et de modification de la chromatine (ADN et histones) qui, à leur tour, peuvent modifier l’expression de gènes de cancer, de gènes suppresseurs de tumeurs ou bien encore celle de miARN. Ces exemples illustrent comment des anomalies génétiques et épigénétiques coopèrent dans les processus pathologiques multifactoriels. La réversibilité des perturbations épigénétiques ouvre en revanche des perspectives pharmacologiques pour le traitement de ces pathologies. De nouveaux médicaments, appelés « épidrogues », agissant pour diminuer la méthylation de l’ADN ou modifier les marques d’histones, ont été mis au point et donnent des résultats très encourageants, en particulier contre certaines leucémies.
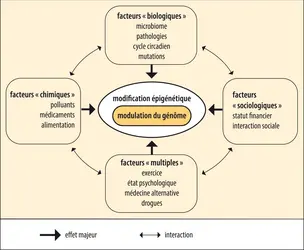
Identité épigénétique et environnement
L’environnement, tel le régime alimentaire, peut modifier l’activité du génome et même orienter le devenir de la totalité d’un organisme. Chez les abeilles, tous les individus de la ruche descendent d’une même reine fondatrice. Les larves destinées à être ouvrières sont nourries de miel et de pollen tandis que les larves destinées à être reines sont nourries exclusivement de gelée royale. Or, la gelée royale inhibe l’activité d’une ADN méthyltransférase : les larves destinées à être reines ont un patron de méthylation (un épigénome) différent de celui des abeilles ouvrières. Cette méthylation différentielle est associée à une différence dans l’expression de leur génome qui se traduit par le phénotype d'« ouvrière » ou celui de « reine ».
Chez l’homme, les vrais jumeaux ont un génome identique et partagent le même environnement in utero. Pourtant, avec le temps et les contingences de leur existence, les épigénomes des jumeaux vont diverger, tout comme leur apparence extérieure va se différencier. Des différences sont observées dans le patron de méthylation ainsi que dans celui d’acétylation des histones chez des vrais jumeaux ayant vécu dans des environnements différents. Il a été montré des défauts de méthylation sur plus d’une centaine de gènes chez plusieurs paires de jumeaux dont l’un souffrait d’une pathologie mentale. Ces observations posent la question de l’implication de ces gènes dans l’étiologie de ces maladies.
Une conséquence de ces constats est que comprendre l’influence de l’environnement (nutrition, polluants, mode de vie, stress, infections, etc.) sur le remodelage de notre épigénome, sur l’expression de nos gènes et donc possiblement sur notre santé, est une question majeure à laquelle les approches épigénétiques tentent de répondre.
Identité cellulaire et reprogrammation épigénétique des cellules souches
Les mécanismes épigénétiques sont des acteurs importants de l’identité cellulaire qui contrôlent l’activité du génome tout au long de la vie et stabilisent les différents états de différenciation des cellules. Les cellules souches de l’embryon avant implantation dans la paroi utérine sont des cellules totipotentes, c’est-à-dire qu’elles sont capables de se différencier en la totalité des types cellulaires. Des cellules souches à capacité de différenciation restreinte sont présentes plus tard dans l’embryon, mais aussi au sein des tissus adultes. Il est possible de les isoler et de les cultiver in vitro, puis de les réimplanter pour tenter de remplacer des cellules déficientes. Plusieurs expérimentations ont déjà été menées en particulier pour réparer les tissus cardiaques endommagés lors d’un infarctus du myocarde. Cependant, ces cellules souches sont peu nombreuses et difficiles à obtenir (techniquement et éthiquement). Une alternative consiste à les recréer in vitro. Pour cela, de nombreuses études tentent de « reprogrammer » le génome d’une cellule différenciée facile d’accès (comme une cellule de la peau) afin qu’elle retrouve son caractère pluripotent, voire totipotent. Une des principales difficultés de cette approche est qu’il faut déverrouiller l’identité cellulaire finale (état « cellule de la peau ») en réinitialisant correctement le programme épigénétique de la cellule pour rendre cette dernière totipotente ou multipotente, sans que la cellule ne meure ou acquière une identité tumorale. Des résultats remarquables en ce sens ont été obtenus, qui ont valu le prix Nobel de physiologie ou médecine en 2012 à Shinya Yamanaka, mais il reste beaucoup à faire pour comprendre les mécanismes impliqués dans cette réinitialisation. Surexpression de facteurs de pluripotentialité, transfert du noyau dans un ovocyte énucléé (clonage), incubation avec des extraits d’œufs de xénope, la recherche est très active pour comprendre « l’alchimie », l’épistasie, de l’épigénétique qui nous donnera accès au contrôle de l’identité cellulaire.
De manière surprenante, des chercheurs ont montré qu’il était possible de « reprogrammer » non plus une cellule, mais le comportement d’un individu, une fourmi, en modifiant son épigénome. Comme chez les abeilles, les fourmis d’une colonie descendent toutes d’une reine. Les fourmis soldats et les fourmis ouvrières partagent le même génome ; pourtant elles ont des comportements bien distincts au sein de leurs colonies. La différence se trouve dans l’expression de gènes impliqués dans la transmission synaptique et dont l’expression différentielle est due à une différence d’acétylation des histones. En traitant de jeunes fourmis soldats avec un inhibiteur de désacétylation des histones ou en bloquant l’expression d’une enzyme de désacétylation, les chercheurs ont observé que ces soldats adoptaient le comportement des ouvrières à la recherche de nourriture. Ces observations interrogent sur la plasticité de l’identité biologique et comportementale, du moins chez les insectes sociaux. Chez la souris, l’inactivation partielle (haplo-insuffisance) de l’histone acétyltransférase responsable de ce phénotype chez la fourmi entraîne des problèmes de cognition et de comportements sociaux. Il existe également chez l’homme une maladie génétique due à une mutation dans ce gène qui entraîne un retard mental (syndrome de Rubinstein-Taybi).
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Pierre-Antoine DEFOSSEZ : directeur de recherche au CNRS
- Olivier KIRSH : maître de conférences, université de Paris-VII-Denis-Diderot
- Ikrame NACIRI : doctorante
Classification
Médias
Autres références
-
ÉPIGÉNÉTIQUE ET THÉORIE DE L'ÉVOLUTION
- Écrit par Laurent LOISON et Francesca MERLIN
- 3 655 mots
- 4 médias
Le terme « épigénétique » est aujourd’hui très en vogue, aussi bien dans la littérature spécialisée que dans la presse de vulgarisation. On y associe souvent une connotation hétérodoxe et polémique, l’épigénétique étant vue comme marquant les limites de la génétique et de la...
-
AUTISME ET TROUBLES DU SPECTRE DE L'AUTISME
- Écrit par Catherine DOYEN
- 6 807 mots
- 4 médias
Enfin,l’épigénétique – c’est-à-dire la connaissance de l’impact de l’environnement sur l’expression des gènes –, prend une place importante dans les études sur le développement des troubles du spectre autistique. Protéger la grossesse et les liens parents-enfants, protéger des infections, etc., a pour... -
CLONAGE
- Écrit par Didier LAVERGNE et Jean-Paul RENARD
- 5 025 mots
- 3 médias
...(cassures, mutations, réarrangement). En outre, l'activité de synthèse d'un génome au cours du développement dépend étroitement de mécanismes de contrôle dits épigénétiques, c'est-à-dire des modifications biochimiques qui n'affectent pas directement la structure de l'ADN mais modifient... -
ENDOMÉTRIOSE
- Écrit par Corinne TUTIN
- 2 846 mots
- 3 médias
...variants génétiques affectant de diverses manières la prolifération et le cycle cellulaires, l’adhésion ou l’inflammation ont été identifiés. Des anomalies épigénétiques, avec modification de l’expression de certains gènes, semblent également jouer un rôle dans l’apparition de l’endométriose. D’autres travaux... -
EXPOSOME
- Écrit par Élodie GIROUX
- 4 797 mots
- 2 médias
...Jones, biochimiste, proposent une définition qui insiste sur l’importance d’inclure la mesure des processus endogènes générés par les expositions, comme les modifications épigénétiques. La focale est ici de nouveau sur l’environnement interne et sur la manière dont l’organisme réagit à l’exposition externe.... - Afficher les 16 références
Voir aussi
- INFARCTUS DU MYOCARDE
- ÉPIGENÈSE
- RÉGIME ALIMENTAIRE
- PRÉFORMATION THÉORIE DE LA, biologie
- ENZYMES
- PRADER-WILLI SYNDROME DE
- ANGELMAN SYNDROME D'
- LOCUS, génétique
- GÉNOTYPE
- ARN MESSAGER ou ARNm
- CYTOSINE
- TRANSCRIPTION, biologie moléculaire
- URACILE
- FAMINES
- TOTIPOTENCE, biologie cellulaire
- CELLULES SOUCHES
- CELLULES SOUCHES EMBRYONNAIRES
- INACTIVATION DU CHROMOSOME X
- ARN NON CODANTS ou ARNnc
- BIOLOGIE MOLÉCULAIRE
- FOLIQUE ACIDE
- SYNDROME
- PLURIPOTENCE, biologie cellulaire
- HISTONES
- WADDINGTON CONRAD HAL (1905-1975)
- ANOMALIES ou ABERRATIONS CHROMOSOMIQUES
- CHROMOSOMES
- CHROMATINE
- ALLÈLE
- RÉGULATION GÉNÉTIQUE
- EXPRESSION GÉNÉTIQUE
- NUCLÉOSOME
- EMPREINTE PARENTALE, génétique
- DIFFÉRENCIATION CELLULAIRE ou CYTODIFFÉRENCIATION
- GESTATION
- NUCLÉOTIDIQUE SÉQUENCE
- GÉNÉTIQUE MOLÉCULAIRE
- CARACTÈRES, biologie
- MÉTHYLATION, biologie moléculaire