ACIDO-BASIQUE ÉQUILIBRE
Évaluation de l'équilibre acido-basique
Toutes les déterminations sont effectuées sur le plasma vrai, c'est-à-dire celui qui a été séparé des éléments figurés par centrifugation dans des conditions strictement anaérobies.
L'acide carbonique existe en fait sous forme de CO2 dissous (moins de 1 p. 100 étant sous forme de H2CO3). On désigne donc sous le terme de CO2 dissous la somme H2CO3 + CO2 définie par l'expression S × pCO2 où S est le coefficient qui relie la somme H2CO3 + CO2 en mmol/l à la pression partielle p du CO2 en mmHg (ou torr). Cette pression est celle de la phase gazeuse en équilibre avec le liquide biologique. Le coefficient S varie avec la température (il est de 0,0301 à 37 0C).
Dans sa définition physiologique, la concentration en bicarbonates comprend non seulement les ions bicarbonates, mais aussi les ions carbonates : l'erreur introduite par cette approximation est faible, pour ce qui est du plasma et du liquide extracellulaire, mais elle est importante pour ce qui est du liquide intracellulaire. En pratique courante, on obtient la concentration en bicarbonates grâce à la relation :
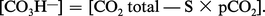
Le CO2 total représente la quantité de CO2 pouvant être extraite du plasma, en présence d'un acide fort : on l'exprime en volumes de CO2 libérés par 100 ml de plasma, ou mieux, en mmol/l. La forme pratique d'utilisation de l'équation d'Henderson-Hasselbach est alors :
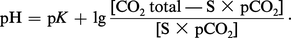
Il existe donc trois méthodes de détermination de l'équilibre acido-basique sanguin :
– mesures du pH et du CO2 total plasmatique, la pCO2 étant dans ce cas obtenue par calcul ;
– mesures du pH et de la pCO2, le CO2 total plasmatique étant alors calculé ;
– mesures du CO2 total plasmatique et de la pCO2, le pH étant déterminé indirectement.
On peut y ajouter la méthode d'interpolation d'Astrup, qui utilise trois mesures de pH : l'un réel, les deux autres sous des pressions de CO2 connues, différentes.
Chez l'adulte normal, on détermine ainsi :

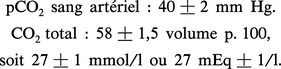
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Pierre KAMOUN : professeur de biochimie à l'université René-Descartes, chef de service à l'hôpital Necker, Paris
Classification
Média
Autres références
-
DIABÈTE
- Écrit par Éric RENARD
- 8 208 mots
- 5 médias
...moyen d'un appareil lecteur de glycémie (glucomètre). La situation décrite est une urgence métabolique qui doit conduire à l'apport immédiat d'insuline. Tout retard expose en effet au coma céto-acidosique. Celui-ci résulte d'une souffrance de l'organisme liée au développement d'une acidose par accumulation... -
KALIÉMIE
- Écrit par François BOURNÉRIAS
- 766 mots
Concentration du cation potassium (K+) dans le plasma, exprimée en milliéquivalent par litre (mEq/l). La mesure par photométrie de flamme est soumise à des causes d'erreurs nombreuses, la plus fréquente étant la lyse des hématies, riches en potassium, qui donne de fausses hyperkaliémies....
-
MILIEU, écologie
- Écrit par Cesare F. SACCHI
- 7 832 mots
- 1 média
...dans l'eau et dans le sol. Il en est de même pour le potentiel d'oxydo-réduction (Eh), qui mesure en pratique le degré d'oxydation du milieu. Les organismes dits basophiles, comme plusieurs plantes (végétaux « calcicoles »), quelques animaux (mollusques terrestres, vers de terre, crustacés),... -
MILIEU INTÉRIEUR
- Écrit par Jean-Paul TRUCHOT
- 3 957 mots
- 4 médias
Lemilieu intérieur est le lieu de transit de nombreux déchets acides ou basiques du métabolisme cellulaire : dioxyde de carbone, acides minéraux et organiques. Les liquides extracellulaires de tous les animaux ont une réaction légèrement alcaline et leur acidification (ou leur alcalinisation) excessive... - Afficher les 8 références