SOLUTION ÉQUILIBRES EN
Réactions de précipitation
Un grand nombre de composés ont une solubilité limitée. Citons la plupart des sulfures, des orthophosphates et des hydroxydes, les oxalates et les sulfates alcalino-terreux, les halogénures d'argent, les oxinates...
Produit de solubilité et solubilité
Produit de solubilité
Soit la réaction de formation de complexe :

Supposons que AX soit peu soluble. Deux situations peuvent se présenter.
1. La solution est saturée de AX ; du solide est alors en excès et on a les deux équilibres simultanés :
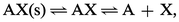
Par exemple :
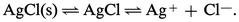
L'application de la loi d'action de masses aux deux équilibres donne :
– pour le premier |AX| = S0 (S0 étant la solubilité propre de AX) ;
– pour le second :
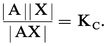
Des deux relations précédentes on tire :
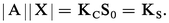
KS est appelé produit de solubilité de AX. On utilise plus commodément pKS = − lgKS. Dans le cas du chlorure d'argent :
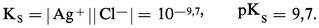
2. La solution n'est pas saturée de AX ; dans ce cas |AX| < S0 et, par conséquent :
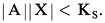
Jamais on ne pourra avoir |A||X| > KS. Si, dans une solution, les concentrations |A| et |X| introduites semblaient devoir vérifier cette dernière inégalité, il précipiterait AX en quantité telle que le produit des concentrations résiduelles |A| et |X| vérifieraient l'égalité au produit de solubilité.
Dans le cas général :
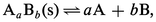
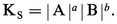
Par exemple, pour Ag2CrO4 :
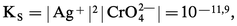
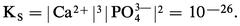
Certains composés sont extrêmement insolubles, comme le sulfure mercurique HgS avec |Hg2+||S2-| = 10-51,8.
Solubilité totale
La solubilité totale S d'un composé AX (exprimée en moles de A dissoutes) est la somme des concentrations de A sous toutes ses formes quand on introduit AX jusqu'à saturation dans une solution quelconque :
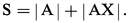
Or |AX| = S0 et |A||X| =KS ; par suite :
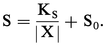
Elle dépend de la présence initiale éventuelle de X. On pourrait, de même, exprimer la solubilité totale de AX en moles de X dissoutes.
Solubilité dans l'eau pure
Si on dissout AX dans l'eau pure, on a :
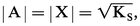
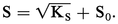
Le terme S0 est souvent très faible et négligeable. On obtient alors :
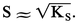
Cette approximation est justifiée dans le cas du chlorure d'argent AgCl. En effet, S0 = 2 × 10-7 mole . l-1 et KS = |Ag+||Cl-| = 2 × 10-10, d'où :
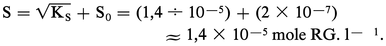
Dans quelques cas, elle ne l'est pas. C'est ainsi que pour l'acétate d'argent AgCH3COO :
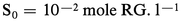
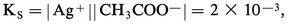
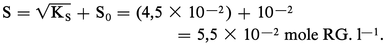
S0 représente près de 20 p. 100 de la solubilité totale de l'acétate d'argent.
Pour un composé de stœchiométrie différente, par exemple le chromate d'argent Ag2CrO4, le produit de solubilité s'écrit :
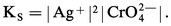
Si on pose |Ag2CrO4| = S0, la solubilité totale peut s'écrire de deux manières selon qu'on l'exprime en moles de Ag+ ou en moles de CrO42-, soit respectivement :
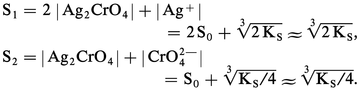
Précipitation par un excès de réactif
Considérons une solution d'ions argent Ag+ à 0,1 mole . l-1 dans laquelle on ajoute des ions chlorure Cl-. Le chlorure d'argent précipite dès que le produit de solubilité est atteint, c'est-à-dire dès que :

S0 étant négligeable et sachant qu'il n'existe pas de complexe supérieur, la solubilité du chlorure d'argent s'écrit :
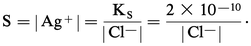
Elle dépend de la concentration : plus |Cl-| est élevée, plus la précipitation est quantitative. Une précipitation complète de l'argent à mieux que 0,1 p.100 près nécessite, outre la quantité de chlorure entraînée dans le précipité, une quantité telle que :
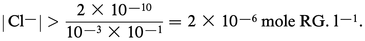
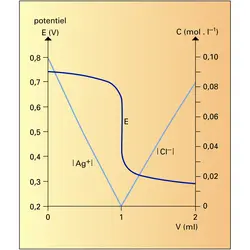
Si on dispose d'un moyen (électrode sélective par exemple) permettant de suivre les variations de concentration de l'une des deux espèces réagissantes, la précipitation par ajout d'un réactif devient une méthode de titrage. Dans l'exemple considéré, un fil d'argent, par l'intermédiaire de son potentiel[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Claude COLIN : docteur-ès-sciences maître-assistant de première classe
- Alain JARDY : docteur-ès-sciences maître-assistant de première classe à l'Ecole Supérieure de Physique et de Chimie Industrielles de Paris
Classification
Médias
Autres références
-
ACIDES & BASES
- Écrit par Yves GAUTIER et Pierre SOUCHAY
- 12 367 mots
- 7 médias
...théorie de la dissociation ionique. Appliquée aux acides et bases, elle permit de préciser les notions précédentes et de les rendre quantitatives. Un acide HA est une substance qui, en solution aqueuse, fournit, lors de son équilibre de dissociation, des protons H+ :une base BOH est une substance...
-
ACTIVITÉ, chimie
- Écrit par Dina SURDIN
- 260 mots
Grandeur introduite par G. N. Lewis, en 1907, pour exprimer les propriétés thermodynamiques des solutions. En effet, l'expression du potentiel chimique d'un composé dans une solution idéale, donné par la relation μ = kT ln N + μ0, où N représente la fraction molaire du composé,...
-
ÉLECTROCHIMIE
- Écrit par Jacques SIMONET
- 6 255 mots
- 10 médias
...vis-à-vis des accepteurs (ou inversement) peut être prévue par la connaissance de grandeurs thermodynamiques (telles que ΔG, variation de l'enthalpie libre) des réactions équilibrées élémentaires vis-à-vis de l'électron :Cette réaction constitue un exemple de transfert d'électron homogène en solution.
-
NITRIQUE ACIDE
- Écrit par Jean ROUXEL
- 1 605 mots
- 4 médias
...déjà 3,5 p. 100 des molécules HNO3. La dilution de l'acide pur dans de l'eau limite cet effet, déplace le dernier équilibre vers la gauche et provoque la réaction 3, de sorte que le bilan global s'identifie à l'équilibre classique d'un acide en solution dans l'eau (réaction 4).