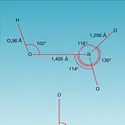
SOLUTION ÉQUILIBRES EN
Article modifié le
Bibliographie
G. Charlot, Les Réactions chimiques en solution aqueuse, Masson, Paris, 7e éd. 1983
C. Colin, A. Jardy & R. Rosset, « Chimie des solutions et informatique, I. Le système fer (III)-H+-oxalate. Détermination potentiométrique de l'acidité libre », in Analysis, vol. XVII, no 8, pp. 425-436, Société française de chimie, Paris, 1989
M.-O. Delcourt, N. Bois & F. Chouaib, Les Équilibres en solution aqueuse et non aqueuse, univ. Paris-XI, Orsay, 1994
R. Rosset, D. Bauer & J. Desbarres, Chimie analytique des solutions et micro-informatique, Masson, 1979 ; Chimie analytique des solutions et informatique, ibid., 2e éd. 1991
E. P. Sergeant, Potentiometry and Potentiometric Titrations, J. Wiley & Sons, 1984, rééd. Krieger Publ., Melbourne (Fla.), 1991.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Claude COLIN : docteur-ès-sciences maître-assistant de première classe
- Alain JARDY : docteur-ès-sciences maître-assistant de première classe à l'Ecole Supérieure de Physique et de Chimie Industrielles de Paris
Classification
Médias
Autres références
-
ACIDES & BASES
- Écrit par Yves GAUTIER et Pierre SOUCHAY
- 12 367 mots
- 7 médias
...théorie de la dissociation ionique. Appliquée aux acides et bases, elle permit de préciser les notions précédentes et de les rendre quantitatives. Un acide HA est une substance qui, en solution aqueuse, fournit, lors de son équilibre de dissociation, des protons H+ :une base BOH est une substance...
-
ACTIVITÉ, chimie
- Écrit par Dina SURDIN
- 260 mots
Grandeur introduite par G. N. Lewis, en 1907, pour exprimer les propriétés thermodynamiques des solutions. En effet, l'expression du potentiel chimique d'un composé dans une solution idéale, donné par la relation μ = kT ln N + μ0, où N représente la fraction molaire du composé,...
-
ÉLECTROCHIMIE
- Écrit par Jacques SIMONET
- 6 255 mots
- 10 médias
...vis-à-vis des accepteurs (ou inversement) peut être prévue par la connaissance de grandeurs thermodynamiques (telles que ΔG, variation de l'enthalpie libre) des réactions équilibrées élémentaires vis-à-vis de l'électron :Cette réaction constitue un exemple de transfert d'électron homogène en solution.
-
NITRIQUE ACIDE
- Écrit par Jean ROUXEL
- 1 605 mots
- 4 médias
...déjà 3,5 p. 100 des molécules HNO3. La dilution de l'acide pur dans de l'eau limite cet effet, déplace le dernier équilibre vers la gauche et provoque la réaction 3, de sorte que le bilan global s'identifie à l'équilibre classique d'un acide en solution dans l'eau (réaction 4).
Voir aussi
- DISSOCIATION IONIQUE
- IONS
- HYDROLYSE
- INDICATEURS COLORÉS
- pK
- RÉACTIONNELS MÉCANISMES
- AMPHOTÈRE CORPS
- AMPHOLYTE
- CHLORURE D'ARGENT
- EAU, physico-chimie
- FORCE D'UN ACIDE ou D'UNE BASE
- OXYDORÉDUCTION
- ÉQUILIBRE, chimie
- POTENTIEL D'OXYDORÉDUCTION
- ÉLECTRODES
- NERNST ÉQUATION DE
- SOLUBILITÉ
- SOLVATATION
- SURSATURATION, physico-chimie
- TITRAGE
- PRÉCIPITATION, chimie
- THERMODYNAMIQUE CHIMIQUE
- ÉLECTRODE AU CALOMEL
- OXYDANTS
- RÉDUCTEUR, chimie
- POTENTIEL CHIMIQUE
- CONCENTRATION, chimie
- DISMUTATION, chimie
- pH
- ACTION DE MASSE LOI D' ou LOI DE GULDBERG & WAAGE
- DISSOLUTION, chimie
- SOLUTION, chimie
- EDTA (acide éthylène-diamine-tétracétique)
- CONSTANTE D'ÉQUILIBRE, chimie
- ACIDITÉ ÉCHELLE D'
- ÉLECTROCHIMIE & ÉLECTROLYSE
- REDOX COUPLE
- TRANSFERT D'ÉLECTRONS