ACÉTYLACÉTIQUE ESTER
L'acide acétylacétique est le nom usuel du butanone-3-oïque :

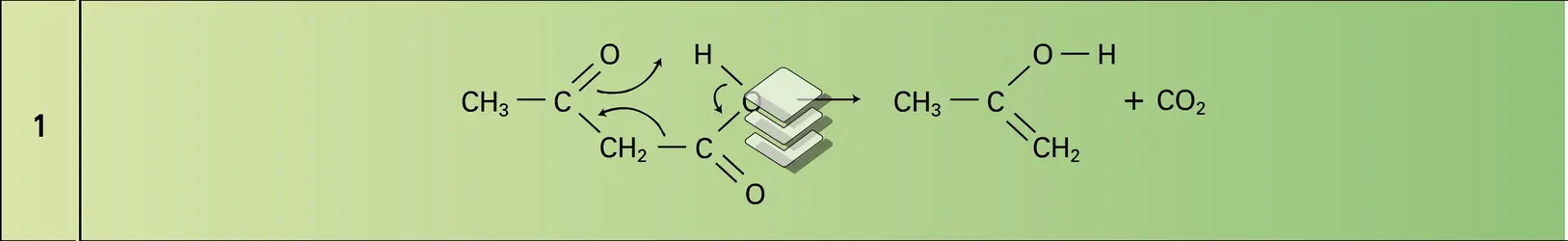
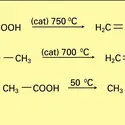
Cet acide a été isolé dans les urines pathologiques. Il peut être obtenu par une hydrolyse prudente de son ester éthylique. Ce dernier, beaucoup plus important, est un intermédiaire utilisé dans l'industrie pharmaceutique et dans celle des colorants. Il intervient dans la synthèse de nombreuses familles chimiques : pyridines, purines, furannes, pyrazoles, pyrroles, etc. Il présente une remarquable tautomérie céto-énolique (protomérie). L'acide est un solide très soluble dans l'eau et il est caractérisé par une très grande instabilité commune à tous les acides β-cétoniques énolisables : par chauffage, il se décarboxyle en énol de l'acétone (réaction 1). Sa capacité de réagir comme nucléophile carboné au niveau du carbone méthylénique central permet de l'utiliser pour introduire sur les substrats électrophiles le groupement acétyle CH3−C=O.
Préparation de l'ester éthylique
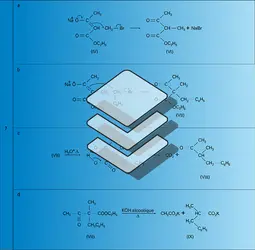
La méthode la plus classique de préparation est la condensation, selon Claisen, de l'ester énolisable acétate d'éthyle, en présence d'un catalyseur basique (éthylate ou amidure de sodium). La base forte arrache un proton à l'acétate d'éthyle pour former, dans une réaction équilibrée, le carbanion conjugué correspondant (la constante d'équilibre, dans le cas de l'éthylate, est d'environ 10-8). Celui-ci attaque une autre molécule d'acétate d'éthyle au niveau du carbone fonctionnel (centre électrophile) en expulsant une molécule d'éthylate de sodium. Ce dernier réagit comme une base vis-à-vis de l'ester acétylacétique formé en donnant, de façon réversible, un sel de sodium avec élimination d'éthanol (la constante d'équilibre est d'environ 103). Le premier équilibre est normalement défavorable à la formation du produit de condensation : on le déplace en éliminant l'éthanol par distillation en continu ; la formation de l'énolate de sodium de l'ester β-cétonique favorise également ce déplacement. La base doit donc être employée en quantité stœchiométrique et l'ester acétylacétique est libéré de son sel par une hydrolyse acide douce (réactions 2). Industriellement, l' acétylacétate d'éthyle est préparé par addition de l'éthanol sur le dicétène (réaction 3).
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
Classification
Médias
Autres références
-
ACÉTIQUE ACIDE
- Écrit par Jacques METZGER
- 2 113 mots
- 3 médias
Ce dernier est un composé dicarbonylé très utile pour certaines synthèses organiques en raison de la facilité avec laquelle, comme les composés organomagnésiens, il fournit des carbanions sur lesquels peuvent se fixer des réactifs électrophiles.