ACÉTYLACÉTIQUE ESTER
Synthèses acétylacétiques et autres réactions
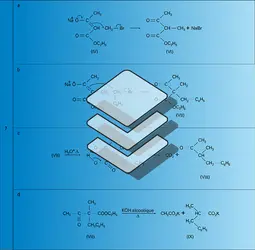
L'anion énolate est un nucléophile ambident, mou au niveau du carbone, dur au niveau de l'oxygène. Ses réactions sont nombreuses : il est alkylé au carbone par les halogénures d'alkyle – électrophiles mous – (réaction 7a) ; l'ester alkylé obtenu peut réagir à nouveau dans les mêmes conditions et conduire au dérivé dialkylé (réaction 7b).
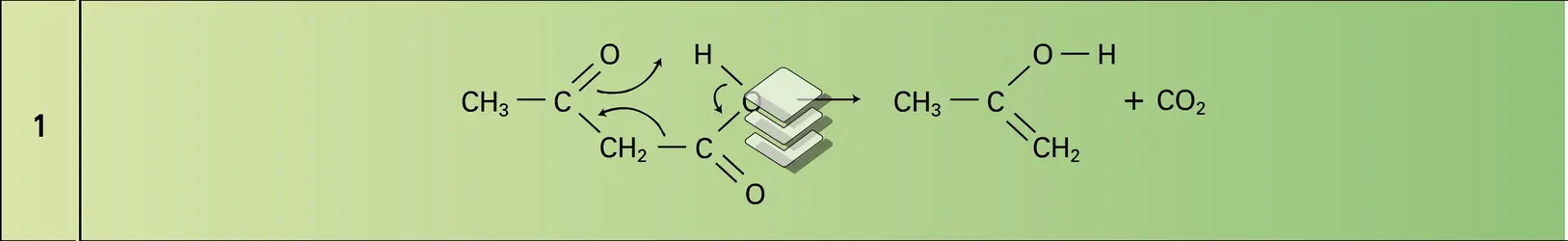
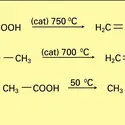
L'hydrolyse acide de ces esters donne l'acide acétylacétique substitué qui se décarboxyle facilement par chauffage et conduit à une méthylcétone (VIII dans la réaction 7c).
Par traitement basique (potasse alcoolique à l'ébullition), ces esters subissent une réaction de fragmentation (rétro Claisen) qui conduit à un acide α-disubstitué (IX dans la réaction 7d).
L'acylation de l'anion énolate par les chlorures d'acides (électrophiles plus durs que les halogénures d'alkyle) donne en général un mélange de dérivés acylés au carbone et acylés à l'oxygène.
En présence d'un catalyseur basique, l'ester acétylacétique s'additionne sur les doubles liaisons activées par conjugaison avec un groupe électro-attracteur comme carbonyle, carboxyle, nitrile, nitro : c'est l'importante réaction de Michael. L'énolate formé par le catalyseur basique attaque le système conjugué. Le bilan de la réaction est une addition-1,2 sur la double liaison, alors que le mécanisme correspond à une addition-1,4 suivie d'une protomérie.
L'anion énolate, formé par action d'une base assez forte comme la pipéridine sur l'ester acétylacétique, s'additionne sur les dérivés carbonylés en formant un alcool qui, s'il est secondaire ou tertiaire, se déshydrate en dérivé alkylidène (X dans la réaction 8).
Réalisée en présence d'ammoniac, cette addition, qui conduit à un substrat éthylénique doublement conjugué (X), se poursuit par une addition de Michael de l'énamine nucléophile (XI) qui résulte de l'amination d'une deuxième molécule d'ester (réaction 9).
La dihydropyridine (XII) ainsi obtenue, soumise à une hydrolyse acide et une oxydation (nitrique), donne finalement la triméthyl-2,4,6 pyridine (XIII, appelée couramment sym collidine). C'est la classique synthèse des pyridines de Hantzsch.
D'autres hétérocycles sont également obtenus par réaction sur l'ester acétylacétique de nucléophiles azotés. C'est le cas de la N-phénylméthylpyrazolone (XIV), intermédiaire important en chimie pharmaceutique et en chimie photographique, qui résulte de la condensation de la phénylhydrazine (réaction 10).
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
Classification
Médias
Autres références
-
ACÉTIQUE ACIDE
- Écrit par Jacques METZGER
- 2 113 mots
- 3 médias
Ce dernier est un composé dicarbonylé très utile pour certaines synthèses organiques en raison de la facilité avec laquelle, comme les composés organomagnésiens, il fournit des carbanions sur lesquels peuvent se fixer des réactifs électrophiles.