ESTERS
Propriétés chimiques
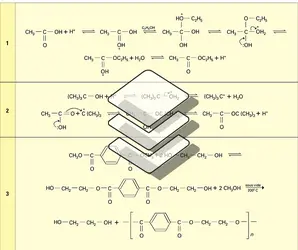
Comme les autres fonctions dérivées de la fonction acide : anhydrides, chlorures, amides, les esters subissent des réactions d'hydrolyse, d'alcoolyse, d'ammonolyse et d'aminolyse qui sont acido- et baso-catalysées.
D'autres réactifs azotés sont couramment mis en œuvre pour préparer, à partir d'eux, des fonctions particulières, dérivées des acides : l'hydroxylamine conduit aux acides hydroxamiques, l'hydrazine aux hydrazides, l'acide azothydrique aux azides.
La réduction des esters peut être réalisée avec les hydrures complexes (LiAlH4, NaBH4), avec le sodium et l'alcool (Bouveault et Blanc), ou l'hydrogène moléculaire en présence de chromite de cuivre : on obtient deux alcools. Cette dernière réaction est pratiquée industriellement pour transformer en alcools primaires à longue chaîne (alcools gras) les esters méthyliques d'acides gras obtenus par méthanolyse des corps gras (réactions).
Les magnésiens réagissent avec les esters en donnant les alcools tertiaires, sans qu'il soit possible d'arrêter la réaction au stade de la cétone.
Une réduction duplicative en α-dicétone est observée sous l'action du sodium en milieu rigoureusement aprotique ; la dicétone est réduite en ène-diolate qu est hydrolysé en acyloïne (réactions).
Comme tous les dérivés de la fonction acide, les esters ont un hydrogène en α relativement acide (pKa 24,5) qui, sous l'action de bases assez fortes, est arraché. Le carbanion résultant, stabilisé par conjugaison, est un excellent nucléophile qui peut s'associer avec de nombreux substrats. Réagissant avec l'ester lui-même, il conduit par la réaction de Claisen aux dérivés acétylacétiques (cf. ester acétylacétiques) ; réagissant avec les halogénures d'alkyle, il conduit à des esters α-substitués.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
Classification
Média
Autres références
-
ACÉTIQUE ACIDE
- Écrit par Jacques METZGER
- 2 113 mots
- 3 médias
Les acétates organiques, autrement dit les esters, sont beaucoup plus importants. Ce sont d'excellents solvants en particulier des nitrates et des acétates de cellulose. Par ailleurs, en présence d'éthanolate de sodium, l'acétate d'éthyle a la propriété de se condenser sur lui-même avec élimination... -
ACÉTYLACÉTIQUE ESTER
- Écrit par Jacques METZGER
- 1 356 mots
- 2 médias
La méthode la plus classique de préparation est la condensation, selon Claisen, de l'ester énolisable acétate d'éthyle, en présence d'un catalyseur basique (éthylate ou amidure de sodium). La base forte arrache un proton à l'acétate d'éthyle pour former, dans une réaction équilibrée, le carbanion... -
ALCOOLS
- Écrit par Jacques METZGER
- 5 834 mots
- 8 médias
La saponification d'esters d'alcools gras naturels, présents dans les cires, libère l'alcool en formant un sel alcalin de l'acide gras (savon). Par exemple, le traitement par la soude du palmitate de cétyle, principal constituant du blanc de baleine, soustrait l'alcool cétylique et forme le palmitate... -
CARBOXYLIQUES ACIDES
- Écrit par Jacques METZGER
- 5 506 mots
- 6 médias
...animales et végétales (cérides), sont des esters d'acides gras et d'alcools à longue chaîne : le blanc de baleine ou palmitate de cétyle est l' ester de l'acide palmitique C15H31CO2H et de l'alcool cétylique C15H31CH2OH (hexadécanol), tandis que la cire de Carnauba renferme en particulier... - Afficher les 14 références