VITREUX ÉTAT
Structure des verres
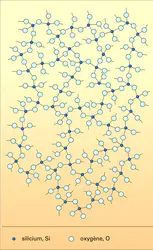
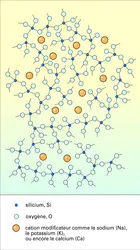
Nous présenterons, pour commencer, un ensemble de données définissant les structures des verres d'oxydes. Puis nous étendrons ces conclusions à des verres non traditionnels dans lesquels l'oxygène est remplacé par un autre non-métal tel que S, Se, Te ou F. Les verres d'oxydes sont constitués d'un réseau tridimensionnel formé par les atomes d'oxygène et les atomes d'un semi-métal A, tels que Si, Ge, B, P, As... Contrairement aux réseaux tridimensionnels et périodiques des produits cristallisés, les réseaux des produits vitreux ne sont pas réguliers, et l'absence de périodicité qui les caractérise les rend peu compacts avec, en leur sein, des espaces vides ou lacunes. Dans ces lacunes sont insérés divers cations Bn+, tels que Na+, K+, Mg2+, Ca2+, Fe3+, etc.
Les atomes A, qui forment avec l'oxygène les réseaux vitreux tridimensionnels, sont appelés formateurs. Les cations Bn+ situés dans les lacunes de ces réseaux sont appelés modificateurs.
Dès 1932, William Zachariasen a formulé un ensemble de règles, qui furent reprises et précisées une dizaine d'années plus tard par Bertram Warren. Ces règles, qui eurent une grande influence sur les recherches concernant les verres, peuvent être décrites de la façon suivante :
– Les atomes formateurs A sont relativement petits. Ils ne peuvent donc être entourés que par un petit nombre d'atomes d'oxygène : trois pour le bore ou l'arsenic, quatre pour le silicium et le germanium. Ces nombres représentent la coordinence de l'atome formateur A.
– Les atomes d'oxygène forment, autour de l'atome formateur A, des motifs structuraux caractéristiques : triangle pour la coordinence 3, tétraèdre pour la coordinence 4. Ces motifs préexistent dans l'état cristallisé. Dans les verres, ils ne sont jamais réguliers et présentent donc des distorsions plus ou moins grandes au sein d'un même réseau. Ce sont les unités structurales constitutives du réseau vitreux, désignées par (AOn), où n est la coordinence de l'élément formateur.
– L'atome d'oxygène ne peut être lié à plus de deux atomes formateurs A. Il peut donc être mis en commun entre deux unités structurales voisines, ou peut n'appartenir qu'à une seule unité.
– Les unités structurales formées par l'oxygène autour des atomes formateurs A ne peuvent mettre en commun qu'un sommet, mais jamais d'arêtes ni de faces.
– Au moins 3 sommets de chaque unité sont partagés avec les unités voisines, réalisant ainsi un réseau tridimensionnel.
Ces règles sont vérifiées dans les verres formés par les oxydes simples A2O3, AO2 ou A2O5, qui peuvent effectivement exister sous forme vitreuse même en l'absence de tout cation modificateur. Par exemple, B2O3, SiO2, GeO2, P2O5 et As2O5 passent à l'état vitreux à la suite d'une fusion et d'un refroidissement convenable. Dans ce cas, tous les atomes d'oxygène sont liés à deux atomes formateurs.
Lorsqu'on applique ces règles aux verres usuels, faisant intervenir un cation modificateur à côté de l'atome formateur, il faut qu'un certain nombre d'atomes d'oxygène ne soient chacun liés qu'à un seul atome formateur A ; la liaison rompue entraîne l'apparition d'une charge négative, destinée à compenser l'une des charges positives des cations modificateurs, de telles sorte que l'ensemble soit électriquement neutre.
Notons qu'un certain nombre d'éléments, dits intermédiaires, peuvent intervenir, parfois dans le même matériau, à la fois comme formateurs et comme modificateurs : tels sont Al, Pb, Zn, Cd, Ti, etc.
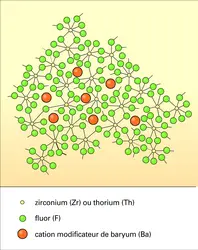
Les descriptions précédentes, destinées aux verres d'oxydes, sont encore valables pour des verres non traditionnels, tels que les verres de chalcogénures ou les verres de fluorures,[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean FLAHAUT : professeur à la faculté de pharmacie de Paris, université René-Descartes, correspondant de l'Institut, membre de l'Académie de médecine
Classification
Médias
Autres références
-
ÉTAT DE LA MATIÈRE, notion d'
- Écrit par Bernard PIRE
- 1 521 mots
...le terme d'état fluide. Pourtant, la plus grande proximité de ses constituants permet que ses propriétés électriques soient fort différentes. De même, l'état vitreux, malgré son aspect solide, a toutes les caractéristiques d'un fluide très visqueux dont les mouvements internes seraient quasi figés.... -
INTERFACES
- Écrit par Simone BOUQUET et Jean-Paul LANGERON
- 8 290 mots
- 8 médias
...liquide, la mobilité des atomes diminue. Cela peut s'effectuer progressivement, le liquide devient alors pâteux (sa viscosité augmente), puis solide. Il n'y a pas de discontinuité dans la transformation, et les molécules conservent à l'état solide le désordre de l'état liquide : c'est l'état amorphe... -
MACROMOLÉCULES
- Écrit par Michel FONTANILLE , Yves GNANOU et Marc LENG
- 13 745 mots
- 5 médias
– La première région correspond à l'état vitreux (état solide). Le module d'élasticité est de l'ordre de 3 × 109 Pa indépendamment de la nature chimique du polymère. Les mouvements portent sur des distances très courtes et se limitent à la vibration, voire à la rotation d'éléments... -
MOLÉCULE
- Écrit par André JULG
- 4 302 mots
...forme de chaînes plus ou moins ramifiées, de taille très variable et de forme indéfinie en raison de leur flexibilité. On a donc un liquide très visqueux qui, par refroidissement va donner un verre, rigide, mais complètement désordonné. Ici encore, on ne peut plus parler véritablement de molécules.