ÉTHANAL ou ACÉTALDÉHYDE ou ALDÉHYDE ACÉTIQUE
Article modifié le
Appelé parfois improprement acétaldéhyde, aldéhyde acétique
ou aldéhyde éthylique
CH3—CHO
Masse moléculaire : 44,05 g
Point d'ébullition : + 21 0C
Liquide incolore, inflammable, à odeur caractéristique, infiniment soluble dans l'eau, l'éthanol, l'éther, le benzène.
L'éthanal, composé type de la série des aldéhydes, est un réducteur, comme tous les aldéhydes ; cette propriété est mise à profit en chimie analytique. Son oxydation, très facile puisqu'elle peut même se produire au contact de l'air, donne l'acide acétique. L'hydrogénation de l'éthanal donne de l'éthanol.
La présence du groupement carbonyle confère à l'éthanal une grande réactivité. Les attaques nucléophiles sont très faciles, du point de vue électronique d'une part (l'oxygène a un effet attracteur d'électrons et il se développe ainsi une charge positive partielle sur le carbone), du point de vue stérique d'autre part (le carbone du carbonyle est peu encombré). L'éthanal peut ainsi donner de nombreuses réactions de condensation. La condensation avec lui-même donne des polymères : le paraldéhyde, (CH3CHO)3, est un trimère, le métaldéhyde, (CH3CHO)4 (combustible méta), est un tétramère.
L'éthanal peut se condenser avec d'autres composés carbonylés. La condensation avec des aldéhydes donne les aldols ou aldéhydes hydroxylés : c'est la réaction d'aldolisation ; selon les conditions réactionnelles, on peut observer aussi la déshydratation de ces aldols et obtenir ainsi des aldéhydes éthyléniques : c'est la réaction de crotonisation. La condensation avec des cétones donne des cétols (cétones hydroxylées). L'éthanal peut aussi se condenser avec des phénols (avec attaque nucléophile sur le noyau aromatique) pour donner des macromolécules, des résines du type bakélite. L'éthanal donne aussi des condensations avec les amines. Selon les conditions de réaction, on peut obtenir de nombreux produits, en particulier des résines dérivées de l'urée.
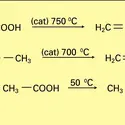
On prépare l'éthanal par oxydation de l'éthanol en présence de dichromate de sodium et d'acide sulfurique.
On l'utilise pour préparer le paraldéhyde, l'acide acétique, le butanol, des parfums, des condiments, des colorants aniliniques, des plastiques, du caoutchouc synthétique ; il sert aussi pour l'argenture des miroirs, et le durcissement des fibres gélatineuses. C'est un composé toxique, irritant les muqueuses, à action narcotique, pouvant provoquer la mort par paralysie respiratoire. Les symptômes de l'intoxication chronique ressemblent à ceux de l'alcoolisme.
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Dina SURDIN : auteur
Classification
Autres références
-
ACÉTIQUE ACIDE
- Écrit par Jacques METZGER
- 2 113 mots
- 3 médias
Pendant de nombreuses années, la fabrication industrielle de l'acide acétique était fondée sur l'oxydation de l'acétaldéhyde à l'air ou à l'oxygène en présence de catalyseur (acétate de cobalt ou de manganèse). Autrefois préparé par hydratation de l'acétylène... -
ALCOOL ÉTHYLIQUE ou ÉTHANOL
- Écrit par Fernand COUSSEMANT
- 694 mots
Alcool primaire, liquide incolore, d'odeur agréable, miscible à l'eau en toutes proportions, miscible à de nombreux solvants organiques, l'éthanol ou alcool éthylique, CH3—CH2OH, a les caractéristiques suivantes :
Masse moléculaire : 46,07 g
Masse spécifique : 0,789 3...
-
ALDÉHYDES ET CÉTONES
- Écrit par Jacques METZGER
- 7 356 mots
- 4 médias
...Les oléfines simples, telles que l'éthylène et le propène, sont oxydées par les sels de palladium en milieu chlorhydrique concentré, respectivement en acétaldéhyde et acétone. Le procédé industriel (Wacker-Hoechst) introduit de l'oxygène pour réoxyder le palladium qui, de ce fait, joue le rôle d'un... -
CARBOXYLIQUES ACIDES
- Écrit par Jacques METZGER
- 5 506 mots
- 6 médias
La fabrication industrielle de l'anhydride acétique met en œuvre deux matières premières différentes : l' acétaldéhyde et l'acide acétique.
Voir aussi