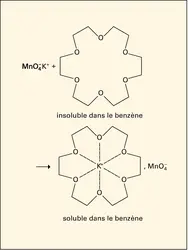
ÉTHERS-OXYDES
Structure et propriétés physiques
La structure géométrique des éthers est assez proche de celles de l'eau et des alcools. L'atome d'oxygène (hybridation sp3) échange avec les deux groupes carbonés des liaisons σ dont l'angle est plus ouvert que dans le cas de l'eau ou des alcools par suite de la répulsion entre les deux groupes alkyle. La conformation de l' éther éthylique est très comparable à celle du n-pentane ; celle du tétrahydrofurane (de masse moléculaire comparable) laisse un atome d'oxygène beaucoup plus dégagé et qui pourra donner lieu à des associations plus solides. Les températures d'ébullition des éthers sont légèrement supérieures à celles des alcanes de masse moléculaire voisine : l'éther méthylique est un gaz, ainsi que l'éther mixte de méthyle et d'éthyle ; elles sont nettement inférieures à celles des alcools correspondants. Les premiers termes sont solubles dans l'eau : l'éther éthylique dissout 1,5 p. 100 d'eau et l'eau en dissout 7,5 p. 100. Ce sont d'excellents solvants qui, par leur fonction oxygénée, présentent une affinité pour les centres acides (électrophiles) et, par leur chaîne hydrocarbonée, manifestent une affinité lipophile.
Du fait de sa volatilité (Téb = 35 0C), l'éther éthylique, dont la densité de vapeur (2,55 g . l-1) représente plus de deux fois celle de l'air, est un solvant dangereux : il a tendance à s'accumuler dans les parties basses du laboratoire et à provoquer des incendies lorsqu'il est au contact d'une flamme, ou même simplement d'un point chaud.
Un autre danger des éthers légers utilisés comme solvants est leur facile oxydation à l'air, qui conduit à la formation d'hydroperoxydes (et de peroxydes) très instables et peu volatils, décelables et dosables par l'iodure de potassium qu'ils oxydent en iode. Ces éthers, dans cette utilisation, doivent être traités par des réducteurs, comme le sulfate ferreux, avant d'être distillés à sec. Le tétrahydrofurane (THF) est moins volatil que l'éther éthylique, il présente des propriétés de solvatation plus marquées (moindre gène stérique à la solvatation) et est miscible à l'eau avec laquelle il forme un azéotrope à 4,3 p. 100 d'eau.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
Classification
Média
Autres références
-
CARBURANTS
- Écrit par Daniel BALLERINI , Jean-Claude GUIBET et Xavier MONTAGNE
- 10 536 mots
- 9 médias
– Des composés oxygénés, du type éther (métyltertiobutyléther ou MTBE, éthyltertiobutyléther ou ETBE) ; leurs indices d'octane dépassent 110 pour le RON et 95 pour le MON ; la présence d'oxygène conférant aux essences des modifications de caractéristiques, leur teneur est limitée à 15 p. 100.... -
HALOGÈNES
- Écrit par Jacques METZGER et Robert de PAPE
- 6 602 mots
- 5 médias
L'alcoolyse conduit aux éthers, elle est voisine de l'hydrolyse : lente pour les halogénures primaires, elle est rapide pour les tertiaires. L'emploi d'un alcoolate accélère la réaction (réaction de Williamson) mais entraîne la réaction parallèle d'élimination (cf. éthers-oxydes) :
-
ORGANOMÉTALLIQUES COMPOSÉS
- Écrit par Jacques METZGER et Charles PRÉVOST
- 4 210 mots
- 2 médias
Les iodures et bromures tertiaires agissent facilement (réaction). Plus réactifs, les éthers sulfuriques, même primaires, conduisent à une condensation analogue. -
OXOLANES
- Écrit par Dina SURDIN
- 62 mots
Composés hétérocycliques à cinq chaînons, comportant un atome d'oxygène. On peut donc les considérer comme des éthers cycliques. L'exemple le plus simple en est le tétrahydrofuranne.
De la même manière, les dioxolanes comportent deux atomes d'oxygène dans un cycle à cinq chaînons...