FLUOR
Article modifié le
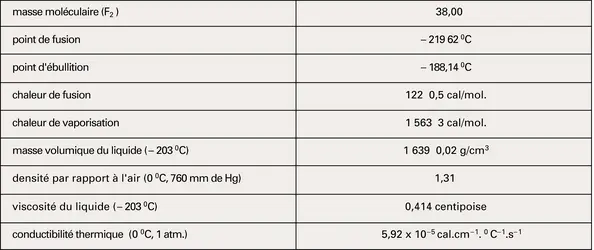
Élément chimique de symbole F et de numéro atomique 9, le premier de la famille des halogènes, le fluor est le plus électronégatif et le plus réactif de tous les éléments chimiques. C'est un gaz faiblement coloré en jaune verdâtre dont l'odeur très forte et irritante rappelle celle de l'ozone. Son inhalation, très nocive, et la brutalité avec laquelle il réagit avec les composés organiques et certains dérivés minéraux en font un produit dangereux que l'on fabrique le plus souvent sur les lieux d'utilisation (usines de séparation isotopique des hexafluorures d'uranium). Les recherches sur les dérivés du fluor, et notamment les composés organofluorés, sont cependant très activement poursuivies, car ces dérivés ont souvent une extraordinaire stabilité thermique et chimique.
État naturel et préparations
Le fluor est un élément relativement abondant dans l'écorce terrestre. Il serait plus abondant que le cuivre, par exemple. On le trouve toujours à l'état combiné. Il est présent sous forme de fluorure de silicium gazeux dans les fumerolles des volcans ainsi que dissous dans les eaux thermales. La source essentielle de fluor est constituée, cependant, par des minerais dont les principaux sont la cryolite (Na3AlF6) et la fluorine, ou spath-fluor (CaF2). Le mot « fluor », qui en latin signifie écoulement, provient d'ailleurs de l'utilisation de la fluorine en métallurgie pour la fluidification des scories. On le rencontre également combiné à un grand nombre d'oxydes sous forme de fluosilicates ou de fluorapatites.
Le fluor est aussi présent dans les végétaux, et principalement dans les graminées. Il joue un rôle important dans le règne animal, où il se trouve essentiellement dans les os et les dents.
Bien que sa présence ait été soupçonnée dans les sels depuis longtemps, la préparation du fluor est relativement récente. La difficulté de cette préparation provient surtout de la réactivité du fluor qui, mis en liberté, réagit immédiatement avec la vapeur d'eau atmosphérique. C'est Henri Moissan qui, en 1886, réussit pour la première fois à l'isoler en électrolysant une solution de fluorure de potassium dans le fluorure d'hydrogène anhydre à l'aide d'électrodes de platine iridié auxquelles il appliquait une différence de potentiel de 50 V. Il maintenait son appareil à basse température pour éviter l'évaporation du gaz fluorhydrique, qui bout à 19 0C. Moissan obtenait ainsi du difluor au pôle positif et du dihydrogène au pôle négatif. L'utilisation d'une membrane évitait la recombinaison des deux gaz.
Les méthodes modernes de préparation du fluor utilisent un principe similaire. Elles sont fondées sur l'électrolyse des sels fondus KH2F3 (tf = 70 0C) ou KH3F4 (tf = 56 0C). Les électrodes sont généralement en carbone. Le fluorure d'hydrogène utilisé pour préparer les fluorures acides de potassium provient de l'attaque de la fluorine par l'acide sulfurique :

La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Josik PORTIER : directeur de recherche au C.N.R.S.
- Encyclopædia Universalis : services rédactionnels de l'Encyclopædia Universalis
Classification
Média
Autres références
-
APATITES
- Écrit par Jean-Claude LUBIN
- 801 mots
Phosphates de chaux naturels, Ca5(PO4)3(OH,F,Cl), les apatites sont des minéraux accessoires des roches éruptives et métamorphiques, fréquents en outre dans les gîtes phosphatés sédimentaires. Le terme, créé en 1808 par Werner, vient du grec apataein (tromper). En effet, on peut confondre...
-
ÉLASTOMÈRES ou CAOUTCHOUCS
- Écrit par Christian HUETZ DE LEMPS et Françoise KATZANEVAS
- 7 902 mots
- 9 médias
Les fluorocarbonés constituent une autre famille d'élastomères très performants. Ils sont composés de 65 à 72 p. 100 defluor, ce qui leur confère une très grande inertie chimique et thermique. Ils peuvent ainsi être utilisés jusqu'à des températures de l'ordre de + 250 0C.... -
FLUORURE D'HYDROGÈNE
- Écrit par Bernard CARTON
- 614 mots
Formule brute : HF
Masse moléculaire : 20,01 g
Point d'ébullition : 19,5 0C
Point de fusion : — 83,1 0C
Température critique : 188 0C.
Gaz incolore d'odeur piquante fumant dans l'air.
Le fluorure d'hydrogène bout déjà à la température ordinaire, mais, refroidi, il forme un...
-
FLUORURES NATURELS
- Écrit par Guy ROGER
- 1 282 mots
- 3 médias
Les fluorures naturels constituent les principales combinaisons du fluor dans l'écorce terrestre et pratiquement les seuls minerais exploitables de cet élément. Celui-ci se trouve pourtant dans beaucoup d'autres minéraux (apatites, silicates), ainsi que dans les fumerolles et certaines sources chaudes....
- Afficher les 12 références
Voir aussi
- TOXICITÉ
- CATALYSEURS
- SÉPARATION ISOTOPIQUE
- CHIMIQUES INDUSTRIES
- FLUORINE ou FLUORITE ou SPATH FLUOR
- CRYOLITHE
- HALOGÉNÉS DÉRIVÉS
- ÉNERGIE NUCLÉAIRE
- TÉFLON ou POLYTÉTRAFLUOROÉTHYLÈNE (PTFE)
- CARIE DENTAIRE
- FLUORHYDRIQUE ACIDE
- DIFLUOR
- OXYDES
- FLUORURES
- ÉLECTROLYSE
- NUCLÉAIRE INDUSTRIE
- HEXAFLUORURE D'URANIUM
- RÉACTIVITÉ CHIMIQUE
- CHLOROFLUOROCARBURES (CFC)