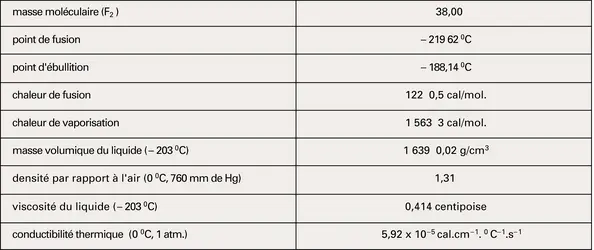
FLUOR
Article modifié le
Propriétés chimiques
La chimie du fluor a commencé à se développer pendant la Seconde Guerre mondiale, en Allemagne, où le fluor était utilisé pour la préparation de fluorures de chlore aux propriétés incendiaires, et aux États-Unis, pour la synthèse de l'hexafluorure d'uranium destiné à la séparation isotopique de l'uranium.
L' extrême réactivité du fluor, due partiellement à sa grande électronégativité et à la relative facilité avec laquelle se dissocie la molécule F2, procure à cet élément des propriétés chimiques exceptionnelles. Il réagit avec presque tous les éléments du tableau périodique, y compris certains gaz rares, ainsi qu'avec la plupart des substances organiques. Cette réactivité particulière explique la difficulté de sa manipulation, qui nécessite l'emploi à basse température de hauts polymères fluorés ou de métaux comme le cuivre ou l'aluminium. Au-delà de 300 0C, seuls des alliages à base de nickel ou des métaux précieux comme le platine ou l'iridium peuvent être utilisés.
Le mélange de dihydrogène et de difluor brûle quelle que soit sa composition. Tous les métaux sont attaqués en donnant naissance à des fluorures dans lesquels le métal possède un degré d'oxydation élevé. Un certain nombre d'entre eux, dans lesquels la liaison métal-fluor est essentiellement covalente, sont gazeux, comme le trifluorure de bore, le tétrafluorure de silicium ou l'hexafluorure d'uranium.
Le fluor réagit également avec les autres halogènes pour donner des combinaisons telles que IF3, BrF3, ClF3. Ces composés à liaisons essentiellement covalentes peuvent présenter, cependant, un caractère ionique qui leur confère une certaine conductibilité à l'état liquide. Le fluor se combine à l'oxygène ; dans l'oxyde F2O, l'oxygène fournit un lien de covalence à chaque atome de fluor (F — O — F). Dans l'oxyde F2O2, c'est au contraire la molécule de difluor qui donne deux électrons à chaque atome d'oxygène (O ← F—F → O).
Les fluorures ioniques possèdent des structures apparentées à celles des oxydes. Cette propriété provient des longueurs voisines du rayon ionique de l'ion O2— et de l'ion F—. On peut citer, par exemple, les fluorures alcalins LiF, NaF, KF... qui, comme les oxydes alcalino-terreux MgO, CaO, SrO..., possèdent la structure du chlorure de sodium. Les fluorures des métaux divalents (MgF2, FeF2, NiF2...) peuvent posséder la structure rutile comme les oxydes correspondants (VO2, TiO2, MnO2...). Il en est de même des fluorures ternaires : KFeF3, par exemple, est isotype de la pérovskite CaTiO3. Par le fait même, il existe de nombreux oxyfluorures dans lesquels le fluor peut se substituer partiellement ou totalement à l'oxygène, par exemple le pyrochlore, minéral de formule chimique (Na,Ca)2Nb2O6(OH,F). Malgré cette analogie, les fluorures ioniques et les oxydes correspondants diffèrent sensiblement par leurs propriétés électriques. En effet, les premiers sont électriquement isolants et les seconds souvent conducteurs. Par ailleurs, alors que de nombreux oxydes présentent une aimantation importante à la température ambiante, il est généralement nécessaire de refroidir les fluorures à de très basses températures pour qu'ils aient la même propriété.
Les composés fluorés organiques jouent un rôle considérable. Leur stabilité particulière contraste avec l'instabilité du fluor lui-même. Dans ces composés, le fluor complète sa couche p en y admettant un autre électron d'un radical organique.
Les réactions de fluoration des composés organiques utilisent généralement l'hydrogène fluoré lui-même ou un de ses composés d'addition :

La substitution des hydrogènes des fonctions carbure peut être totale. Elle conduira à des composés d'une stabilité exceptionnelle[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Josik PORTIER : directeur de recherche au C.N.R.S.
- Encyclopædia Universalis : services rédactionnels de l'Encyclopædia Universalis
Classification
Média
Autres références
-
APATITES
- Écrit par Jean-Claude LUBIN
- 801 mots
Phosphates de chaux naturels, Ca5(PO4)3(OH,F,Cl), les apatites sont des minéraux accessoires des roches éruptives et métamorphiques, fréquents en outre dans les gîtes phosphatés sédimentaires. Le terme, créé en 1808 par Werner, vient du grec apataein (tromper). En effet, on peut confondre...
-
ÉLASTOMÈRES ou CAOUTCHOUCS
- Écrit par Christian HUETZ DE LEMPS et Françoise KATZANEVAS
- 7 902 mots
- 9 médias
Les fluorocarbonés constituent une autre famille d'élastomères très performants. Ils sont composés de 65 à 72 p. 100 defluor, ce qui leur confère une très grande inertie chimique et thermique. Ils peuvent ainsi être utilisés jusqu'à des températures de l'ordre de + 250 0C.... -
FLUORURE D'HYDROGÈNE
- Écrit par Bernard CARTON
- 614 mots
Formule brute : HF
Masse moléculaire : 20,01 g
Point d'ébullition : 19,5 0C
Point de fusion : — 83,1 0C
Température critique : 188 0C.
Gaz incolore d'odeur piquante fumant dans l'air.
Le fluorure d'hydrogène bout déjà à la température ordinaire, mais, refroidi, il forme un...
-
FLUORURES NATURELS
- Écrit par Guy ROGER
- 1 282 mots
- 3 médias
Les fluorures naturels constituent les principales combinaisons du fluor dans l'écorce terrestre et pratiquement les seuls minerais exploitables de cet élément. Celui-ci se trouve pourtant dans beaucoup d'autres minéraux (apatites, silicates), ainsi que dans les fumerolles et certaines sources chaudes....
- Afficher les 12 références
Voir aussi
- TOXICITÉ
- CATALYSEURS
- SÉPARATION ISOTOPIQUE
- CHIMIQUES INDUSTRIES
- FLUORINE ou FLUORITE ou SPATH FLUOR
- CRYOLITHE
- HALOGÉNÉS DÉRIVÉS
- ÉNERGIE NUCLÉAIRE
- TÉFLON ou POLYTÉTRAFLUOROÉTHYLÈNE (PTFE)
- CARIE DENTAIRE
- FLUORHYDRIQUE ACIDE
- DIFLUOR
- OXYDES
- FLUORURES
- ÉLECTROLYSE
- NUCLÉAIRE INDUSTRIE
- HEXAFLUORURE D'URANIUM
- RÉACTIVITÉ CHIMIQUE
- CHLOROFLUOROCARBURES (CFC)