GAZ RARES ou GAZ NOBLES
Article modifié le
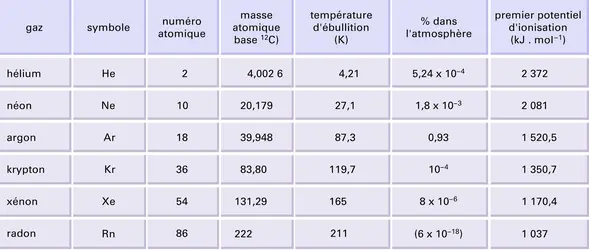
L'hélium, le néon, l'argon, le krypton, le xénon et le radon forment la famille des gaz rares, groupe zéro de la classification périodique des éléments chimiques. Tous monoatomiques, ces gaz sont caractérisés par leur très grande inertie chimique, d'où les qualificatifs de nobles ou d'inertes qui leur sont quelquefois donnés. Cette remarquable inertie s'explique par l'existence d'une couche électronique extérieure saturée, à deux électrons pour l'hélium, à huit pour les autres, configuration similaire à celle de nombreux ions stables (théorie de l'octet).
Les gaz rares ont une affinité électronique presque nulle et des potentiels d'ionisation extrêmement élevés. En conséquence, dans des conditions normales, ils ne gagnent ni ne perdent d'électrons et ne forment pas de liaisons : les seules forces qui lient les atomes entre eux sont des forces de Van der Waals. Ces gaz sont caractérisés par des points de fusion et d'ébullition très bas, ce qui, dans le cas de l'hélium, permet d'atteindre des températures très voisines du zéro absolu. L'hélium présente la particularité de n'exister à l'état solide que sous pression et de présenter à l'état liquide deux phases, dont une, l'hélium II, a des propriétés de superfluidité qui n'appartiennent à aucune autre substance.
Produit de la désintégration du radium, le radon est lui-même radioactif : il se dégrade en polonium avec une période inférieure à quatre jours. Les autres gaz rares sont stables. Leurs principales utilisations (essentiellement celles de l'argon et de l'hélium) sont la création d'atmosphère neutre pour la soudure à l'arc de l'aluminium, du magnésium, des aciers inoxydables, du titane, et pour l'élaboration de certains métaux.
L'hélium
En 1868, Jules Janssen et Joseph Norman Lockyer observèrent indépendamment une raie jaune nouvelle dans le spectre solaire. Georges Rayet eut l'idée que cette raie pouvait être émise par un élément inconnu, mais ce furent Edward Frankland et J. N. Lockyer qui en firent la preuve, et ils appelèrent cet élément hélium (du grec hêlios, « soleil »).
C'est seulement en 1895 que William Ramsay découvrit l'hélium dans un minerai uranifère, la clévéite, et le classa parmi les éléments terrestres. La même année, Heinrich Kayser détecta sa présence dans l'atmosphère.
État naturel, production et utilisation
L'hélium (symbole He) entre continuellement en très faible quantité dans l'atmosphère sous forme de particules alpha des rayons cosmiques. Il est produit, également sous forme de particules alpha, par la désintégration de plusieurs éléments radioactifs dans la croûte terrestre ; l'hélium ainsi formé chemine à travers la lithosphère et passe soit dans l'atmosphère, soit dans certaines poches de gaz naturels. Les atomes d'hélium ont une masse très faible et peuvent échapper partiellement à l'attraction de la Terre. Il s'est établi un équilibre entre les pertes et les gains d'hélium par l'atmosphère, où sa concentration est constante : 5,3 cm3 d'hélium par mètre cube d'air.
L'hélium accumulé dans les poches de gaz naturels constitue la réserve la plus importante ; c'est une valorisation non négligeable du gaz naturel. Les sources les plus connues sont situées aux États-Unis, près d'Amarillo (Texas). Des sources sont exploitées également en Pologne et au Canada (Saskatchewan).
L'hélium est extrait du mélange de gaz en liquéfiant sous pression à basse température successivement tous les constituants sauf l'hélium. Les impuretés que contient la phase ultime sont éliminées par adsorption sur du charbon actif à la température de l'azote liquide. Actuellement, plusieurs installations[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Paul ALLAMAGNY : chef de service au département recherches et applications d'Air liquide
- Albert LACAZE : professeur à l'université scientifique et médicale de Grenoble
- Nathalie LEMAITRE : doctorat d'État, sous-directeur adjoint à l'Impact sanitaire, Office de protection contre les rayonnements ionisants
- Encyclopædia Universalis : services rédactionnels de l'Encyclopædia Universalis
Classification
Médias
Autres références
-
AIR
- Écrit par Jean PERROTEY
- 2 155 mots
- 2 médias
...étudie dans un eudiomètre l'effet des étincelles électriques sur de l'air suroxygéné, les oxydes d'azote formés étant absorbés par de l'eau savonneuse. Cavendish constate, après élimination de l'oxygène en excès, la présence d'un résidu non absorbable, ce qui constitue la première mise en évidence de... -
BARTLETT NEIL (1932-2008)
- Écrit par Pierre LASZLO
- 721 mots
Chimiste américain d'origine britannique, Neil Bartlett est né le 15 septembre 1932 à Newcastle-upon-Tyne (Royaume-Uni), et mort le 5 août 2008 à Walnut Creek (Californie). Sa découverte majeure consiste en l'obtention du tout premier composé d'un gaz rare.
Sa vocation naquit...
-
CASSINI-HUYGENS (MISSION)
- Écrit par Athéna COUSTENIS
- 4 465 mots
- 9 médias
...l’atmosphère du satellite. Bien que des instruments de la mission aient fourni des informations importantes sur sa formation et son évolution en mesurant les gaz nobles (tels que l'argon détecté pour la première fois) et leurs abondances isotopiques, tout n’est pas encore connu. Aussi, le méthane, qui reproduit... -
CLAUDE GEORGES (1870-1960)
- Écrit par Bernard BACH
- 335 mots
Inventeur industriel et praticien remarquable par l'étendue et la diversité de ses travaux. Chimiste de formation (ancien élève de l'École de physique et chimie), Georges Claude commence sa carrière de technicien par ses travaux sur la dissolution de l'acétylène dans l'acétone (cette découverte...
- Afficher les 9 références
Voir aussi