GAZ RARES ou GAZ NOBLES
Les autres gaz rares
L' argon, le krypton, le xénon et le néon ont été découverts dans l'atmosphère terrestre : l'argon par William Ramsay et lord Rayleigh en 1894 ; le krypton, le xénon et le néon par W. Ramsay et Morris Williams Travers en 1898. Le radon a été découvert par Ernst Dorn en 1900 dans les produits de désintégration du radium.
Propriétés physiques
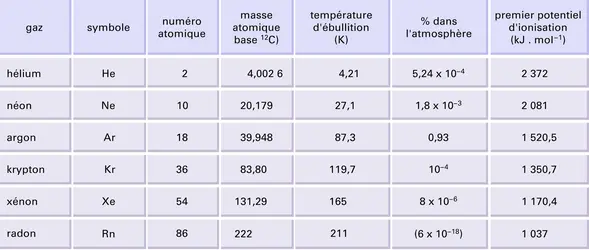
Ce sont des gaz incolores, inodores et sans saveur, très difficiles à liquéfier. Leurs principales propriétés physiques sont données dans le tableau. La conductivité thermique de l'argon, plus faible que celle de l'azote, le fait utiliser dans les lampes électriques à filament incandescent : la température étant plus élevée, la lumière est plus blanche qu'avec une atmosphère d'azote. Cette qualité est encore renforcée avec un mélange, plus coûteux, de krypton et de xénon. Les tubes dits « au néon » sont des tubes à décharge à haute tension renfermant des mélanges de gaz rares sous une très faible pression (quelques millièmes de millimètre de mercure). Ce sont alors les propriétés spectrales des gaz qui interviennent. La couleur obtenue dépend du gaz : bleu verdâtre pour l'argon associé à de la vapeur de mercure, rose pour l'hélium, rouge orangé pour le néon, bleu pâle pour le krypton, bleu vert pour le xénon ; ces teintes peuvent être modifiées en mélangeant les gaz. Enfin, les tubes dits fluorescents, de plus en plus employés pour l'éclairage, renferment une atmosphère d'argon.
Propriétés chimiques
Dès la découverte de l'argon, Ramsay et Rayleigh tentèrent sans succès de combiner cet élément. De nombreux chercheurs, refusant d'admettre la théorie de l'octet, essayèrent, par l'expérience ou le calcul, de réaliser et de prévoir des réactions avec les autres éléments.
A. von Antropoff, en 1924, fut l'un des premiers à suggérer l'existence possible de composés de gaz rares en les considérant comme ayant une valence maximale égale à huit. C'est ensuite Linus Pauling qui, en 1933, envisagea l'éventualité de former des fluorures et des sels oxygénés. Cette même année, D. Yost et A. L. Kaye furent tout près de réussir en irradiant un mélange de xénon et de chlore, mais malheureusement ils n'étendirent pas leur méthode au fluor, lequel était, à l'époque, d'une manipulation très délicate.
Finalement, excepté quelques clathrates et de nombreuses combinaisons métalliques, aucun composé vrai ne fut isolé et, en 1962, les gaz rares devaient encore être considérés comme vraiment « inertes ».
C'est alors que N. Bartlett obtint le premier composé vrai du xénon, l'hexafluoroplatinate, qui fut à l'origine de la chimie des gaz rares. Mis à part le radon, qui est radioactif, et le krypton, qui a quelques composés (KrF2 ; KrF4 ; KrF2, 2 SbF5 ; Kr2O4Ba ; HKrCCH), cette chimie est entièrement celle du xénon ; en effet, toutes les tentatives pour faire entrer l'hélium et le néon dans une combinaison chimique se sont soldées par un échec, et un seul composé stable de l’argon est actuellement connu, le fluorohydrate d’argon HArF, synthétisé en 2000 à basse température (environ 10 K) par une équipe de l’université d’Helsinski.
La conséquence principale de la découverte de ces composés a été une évolution et une adaptation de la théorie de la « liaison chimique ». En ce qui concerne leurs utilisations, on a eu quelques espoirs : l'existence de fluorures de xénon indiquait une technique possible pour séparer le xénon du krypton, et extraire le xénon radioactif qui prend naissance dans les piles atomiques ; par ailleurs, certains composés (XeO3 ; XeO4) sont doués de propriétés explosives. Mais la relative rareté du xénon et par suite le prix de revient de ses composés, alliés à la difficulté de[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Paul ALLAMAGNY : chef de service au département recherches et applications d'Air liquide
- Albert LACAZE : professeur à l'université scientifique et médicale de Grenoble
- Nathalie LEMAITRE : doctorat d'État, sous-directeur adjoint à l'Impact sanitaire, Office de protection contre les rayonnements ionisants
- Encyclopædia Universalis : services rédactionnels de l'Encyclopædia Universalis
Classification
Médias
Autres références
-
AIR
- Écrit par Jean PERROTEY
- 2 155 mots
- 2 médias
...étudie dans un eudiomètre l'effet des étincelles électriques sur de l'air suroxygéné, les oxydes d'azote formés étant absorbés par de l'eau savonneuse. Cavendish constate, après élimination de l'oxygène en excès, la présence d'un résidu non absorbable, ce qui constitue la première mise en évidence de... -
BARTLETT NEIL (1932-2008)
- Écrit par Pierre LASZLO
- 721 mots
Chimiste américain d'origine britannique, Neil Bartlett est né le 15 septembre 1932 à Newcastle-upon-Tyne (Royaume-Uni), et mort le 5 août 2008 à Walnut Creek (Californie). Sa découverte majeure consiste en l'obtention du tout premier composé d'un gaz rare.
Sa vocation naquit...
-
CASSINI-HUYGENS (MISSION)
- Écrit par Athéna COUSTENIS
- 4 465 mots
- 9 médias
...l’atmosphère du satellite. Bien que des instruments de la mission aient fourni des informations importantes sur sa formation et son évolution en mesurant les gaz nobles (tels que l'argon détecté pour la première fois) et leurs abondances isotopiques, tout n’est pas encore connu. Aussi, le méthane, qui reproduit... -
CLAUDE GEORGES (1870-1960)
- Écrit par Bernard BACH
- 335 mots
Inventeur industriel et praticien remarquable par l'étendue et la diversité de ses travaux. Chimiste de formation (ancien élève de l'École de physique et chimie), Georges Claude commence sa carrière de technicien par ses travaux sur la dissolution de l'acétylène dans l'acétone (cette découverte...
- Afficher les 9 références